ЗНО онлайн 2015 року з хімії – основна сесія
Тестові завдання основної сесії ЗНО 2015 року з хімії
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
Молекулярні формули речовин, про які йдеться в завданні, різні, тому їхні найпростіші та структурні формули не можуть бути однаковими.
Якісний склад у цих речовин однаковий, бо їхні молекулярні формули містять однакові набори символів хімічних елементів, натомість кількісний склад різний, бо індекси біля символів Гідрогену й Оксигену різні.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати природу хімічного елемента за його положенням у періодичній системі.
| Символи хімічних елементів | ||
| металічних | неметалічних | |
| A | – | |
| Б | ||
| B | ||
| Г | – | |
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати формули леткої сполуки хімічного елемента з Гідрогеном, вищого оксиду і його гідрату за положенням елемента в періодичній системі.
Хімічний елемент із протонним числом 16 – Сульфур, формула гідроген сульфіду
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів.
Нуклід – це різновид атомів або йонів з однаковим масовим числом (кількість нуклонів) та атомним номером (кількістю протонів).
Нуклідним символом називають символ нукліда елемента, біля якого зазначено атомний номер як лівий підрядковий, а масове число – як лівий надрядковий індекс.
Нуклони – це протони й нейтрони. Нейтронне число
Якщо кількість протонів і нейтронів однакова, то нуклонне число є парним. Цій умові відповідає нуклід
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів. Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів з огляду на їхнє місце в періодичній системі.
В атомі хімічного елемента 17 електронів (6
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна формула. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
Складниками фторапатиту є двозарядні катіони Кальцію, тризарядні фосфат-аніони, однозарядні флуорид-аніони:
Згідно з принципом електронейтральності речовини (сума зарядів складників дорівнює нулю) можна скласти алгебричне рівняння:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Типи кристалічних ґраток.
Завдання скеровано на перевірку вміння прогнозувати тип кристалічних ґраток у речовині за її властивостями.
Описані властивості – низька температура плавлення, леткість властиві речовинам з молекулярними кристалічними ґратками. Сили притягання між молекулами у вузлах кристалічних ґраток слабкі, тому речовина має порівняно низькі температури плавлення і кипіння, легко випаровується.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин, розрізняти окисники й відновники.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю.
Окиснення – утрачання електронів атомом або йоном, відновлення – процес, протилежний окисненню.
Окисники приєднують електрони, відновники – віддають.
У цій реакції плюмбум(IV) оксид є окисником, а в зміні ступеня окиснення Сульфуру беруть участь шість електронів.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні й органічні речовини, їхні властивості.
Завдання скеровано на перевірку знання властивостей амоніаку, гідроген хлориду, нітроген(I) оксиду, нітроген(IV) оксиду, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею.
Із-поміж наведених у завданні речовин добре розчинними є гідроген хлорид, амоніак, нітроген(IV) оксид. Тому їх не збирають витісненням води. Метан – малорозчинний газ, його можна зібрати витісненням води.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
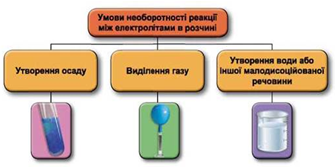
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині реагують між собою барій гідроксид і ферум(ІІІ) хлорид, бо внаслідок взаємодії катіона Феруму(ІІІ) з гідроксид-аніонами утворюється нерозчинний ферум(ІІІ) гідроксид:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати осно́вні, кислотні, амфотерні оксиди й прогнозувати можливість перебігу хімічних реакцій за їхньої участі.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
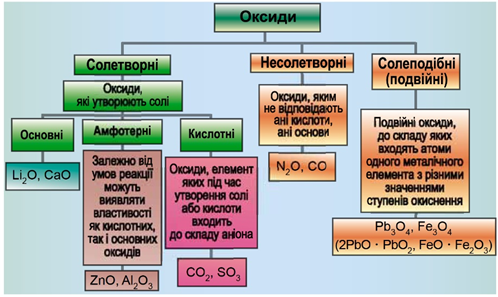
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію (
\(\mathrm{Mg-Ra}\) ) - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості. Цинк оксид й алюміній оксид – амфотерні.
Магній оксид – основний, алюміній оксид – амфотерний, хлор(VІІ) оксид – кислотний.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку знання способів добування лугів, уміння розрізняти луги за їхніми хімічними формулами.
Фенолфталеїн – специфічний індикатор лужного середовища, під дією гідроксид-аніонів у водному розчині він набуває малинового забарвлення.
Унаслідок розчинення барій оксиду у воді відбувається хімічна реакція, продуктом якої є луг – барій гідроксид:
У водному розчині барій гідроксид дисоціює на катіони Барію і гідроксид-аніони:
Унаслідок розчинення амоніаку у воді утворюються гідроксид-аніони й катіони амонію:
У водному розчині кальцій гідроксид дисоціює на катіони Кальцію і гідроксид-аніони:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислотні оксиди. Способи добування кислот.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій кислотних оксидів з водою.
З-поміж кислот, формули яких наведено в завданні, лише силікатну не можна добути реакцією відповідного кислотного оксиду з водою, адже силіцій(IV) оксид – це кварц, який у воді не розчиняється і не реагує з нею.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку вміння розпізнавати солі за їхніми хімічними формулами.
Солі – йонні сполуки, утворені катіонами металічних елементів або амонію й аніонами кислотних залишків. Кислі солі – продукти неповного заміщення атомів Гідрогену в молекулі кислоти на катіони амонію або металічних елементів.
У завданні наведено формули солей – натрій етаноату (1), калій перманганату (4), амоній дигідрогенкарбонату (6).
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Явище амфотерності.
Завдання скеровано на перевірку розуміння суті амфотерності, уміння аналізувати й прогнозувати результати дослідження, робити висновки.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або основні, або кислотні властивості. Наприклад, із кислотами цинк гідроксид реагує як основа, із лугами – як кислота. Тобто білий драглистий осад цинк гідроксиду розчиниться як у кислоті, так і в надлишку розчину лугу.
Описані перетворення можна пояснити за допомогою таких хімічних рівнянь:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості солей для розпізнавання їх за допомогою якісних реакцій.
Без утворення твердого залишку розкладаються дві солі – амоній карбонат (A) й амоній хлорид (B). Однак із-поміж них лише амоній карбонат реагує з кальцій гідроксидом з утворенням осаду – кальцій карбонату:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і визначати окисники й відновники.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю.
Окиснення – утрачання електронів атомом або йоном, відновлення – процес, протилежний окисненню.
Окисники приєднують електрони, відновники – віддають.
У цій реакції Натрій не змінює ступінь окиснення:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійну твердість води зумовлено катіонами
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Оксид і гідроксид Алюмінію.
Завдання скеровано на перевірку знання властивостей алюміній оксиду й алюміній гідроксиду.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або основні, або кислотні властивості. Оксид і гідроксид Алюмінію реагують як із кислотами, так і з лугами. Тобто є амфотерними:
Алюміній гідроксид за нагрівання розкладається на алюміній оксид і воду:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза та сполук Феруму(ІІ) і Феруму(ІІІ).
А
Б
В
Г
Ферум є відновником у реакції ферум(ІІ) хлориду з хлором.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Галогени.
Завдання скеровано на перевірку вміння прогнозувати здатність галогенів витісняти один одного із солей у водних розчинах.
Окиснювальні властивості галогенів зменшуються в підгрупі зі збільшенням протонного числа. Хлор витісняє йод із калій йодиду у водному розчині:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Кисень.
Завдання скеровано на перевірку знання способів добування кисню.
У лабораторії кисень добувають з гідроген пероксиду (1), калій перманганату (3), натрій нітрату (5):
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Амоніак.
Завдання скеровано на перевірку вміння пояснювати результати досліду хімічними властивостями амоніаку.
Фенолфталеїн – специфічний індикатор лужного середовища, у якому він під дією гідроксид-аніонів набуває малинового кольору. З-поміж речовин, хімічні формули яких наведено в завданні, лише розчин амоніаку у воді має лужне середовище. Унаслідок розчинення амоніаку у воді утворюються гідроксид-аніони й катіони амонію:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Карбон(IV) оксид.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій за участі неорганічних речовин різних класів.
З-поміж речовин, назви яких наведено в завданні, потрібно вибрати ту, яка реагує з карбон(IV) оксидом і не реагує з киснем. Цим умовам відповідає натрій гідроксид:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Систематична номенклатура органічних сполук.
Завдання скеровано на перевірку вміння розпізнавати органічні сполуки різних класів і називати їх за систематичною номенклатурою.
У завданні наведено структурну формулу естеру, молекула якого утворена залишками пропанової кислоти й етанолу, тож його назва – етилпропаноат.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкани.
Завдання скеровано на перевірку вміння обчислювати кількість атомів хімічних елементів у молекулах алканів за загальною формулою вуглеводнів цього гомологічного ряду.
Загальна формула вуглеводнів гомологічного ряду алканів
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкани. Алкени.
Завдання скеровано на перевірку вміння порівнювати хімічні властивості алканів й алкенів.
Етан й етен за нормальних умов є газами, бо зріджуються за від’ємної температури (1) і взаємодіють із бромом (4) – етан вступає з ним у реакцію заміщення, а етен – приєднання.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості алкінів.
Завдання скеровано на перевірку знання хімічних властивостей алкінів, уміння прогнозувати продукти реакцій за їхньої участі.
Продуктом каталітичної гідратації етину є етаналь (реакція Кучерова):
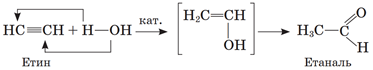
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості бензену.
Завдання скеровано на перевірку знання хімічних властивостей бензену, уміння прогнозувати перебіг реакцій за його участі.
Тримеризація етину – один зі способів добування бензену:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Природні джерела вуглеводнів.
Завдання скеровано на перевірку розуміння суті процесів нафтоперегонки й нафтопереробки.
Лише на фізичних процесах випаровування і конденсування складників нафти за різних температур ґрунтується її ректифікація. Решта процесів пов’язані з хімічними перетвореннями компонентів нафти.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Багатоатомні спирти.
Завдання скеровано на перевірку знання властивостей гліцеролу.
Гліцерол – насичений триатомний спирт. У молекулі гліцеролу три гідроксильні групи, тому він вступає в реакцію естерифікації. Гліцерол взаємодіє зі свіжоосадженим купрум(ІІ) гідроксидом з утворенням яскраво-синього прозорого розчину.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Властивості спиртів.
Завдання скеровано на перевірку знання хімічних властивостей метанолу.
Продуктом окиснення метанолу є метаналь:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Естери. Жири.
Завдання скеровано на перевірку знання хімічного складу й властивостей естерів і жирів.
Жири – естери триатомного спирту гліцеролу й вищих карбонових кислот. Естери вищих одноосновних карбонових кислот і вищих одноатомних спиртів, про які йдеться в завданні, є основою природних восків. Тобто це твердження неправильне.
Одним із продуктів кислотного гідролізу етилметаноату є метанова кислота, яку можна окиснити амоніачним розчином аргентум(І) оксиду:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи.
Завдання скеровано на перевірку знання продуктів часткового гідролізу крохмалю.
Продуктом часткового гідролізу крохмалю, із якого під дією високої температури на хлібі утворюється скоринка, – декстрин.
Щодо інших варіантів відповіді: глюкоза й фруктоза – продукти повного гідролізу крохмалю, глікоген має тваринне походження, це основний запасний вуглевод організму людини і тварин.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Якісні реакції на органічні речовини.
Завдання скеровано на перевірку вміння розрізняти органічні речовини за допомогою якісних реакцій.
У завданні описано послідовність і результати проведення якісних реакцій на білки – біуретової і ксантопротеїнової.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Високомолекулярні органічні сполуки.
Завдання скеровано на перевірку суті реакції полімеризації.
Здатність молекул до полімеризації зумовлена подвійними або потрійними зв’язками в їхніх молекулах. Під час полімеризації кратні зв’язки розриваються і переходять в ординарні. Сполучення мономерів у полімери відбувається за місцем розриву подвійних чи потрійних зв’язків.
До полімеризації здатні алкени, загальна формула яких
Алкани
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
1 у реакцію заміщення вступають проста і складна речовини, утворюються нові проста і складна речовини – Г
2 у реакцію обміну вступають дві складні речовини, утворюються дві нові складні речовини – Б
3 у реакцію розкладання вступає одна складна речовина, утворюється кілька речовин – Д
4 у реакцію сполучення вступає кілька речовин, утворюється одна складна речовина –А
Відповідь: 1Г, 2Б, 3Д, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Хімічні властивості неорганічних речовин.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участі неорганічних речовин.
1 продуктами реакції цинку й хлоридної кислоти є цинк хлорид і водень – Б
2 продуктами реакції цинку й хлору є цинк хлорид – А
3 продуктами реакції цинк гідроксиду й хлоридної кислоти є цинк хлорид і вода – В
4 продуктами стоплення цинк оксиду й натрій гідроксиду є натрій цинкат і вода – Д
Відповідь: 1Б, 2А, 3В, 4Д.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних речовин.
Завдання скеровано на перевірку вміння класифікувати неорганічні речовини за їхніми формулами.
1 складна речовина, утворена катіонами металічного елемента й аніонами залишку хлорaтної кислоти – середня сіль – Б
2 складна речовина утворена катіонами Алюмінію і гідроксид-аніонами, яка реагує як із кислотами, так і з лугами, – амфотерний гідроксид – В
3 бінарна сполука металічного елемента з киснем, у якій ступінь окиснення Оксигену становить –2 – Г
4 продукт неповного заміщення атомів Гідрогену в молекулі сульфітної кислоти на атоми Натрію – кисла сіль – Д
Відповідь: 1Б, 2В, 3Г, 4Д.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Класифікація реакцій в органічній хімії.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за участі органічних сполук.
1 лужний гідроліз етилетаноату – Г
2 за освітлення бензен приєднує хлор з утворенням гексахлороциклогексану – А
3 фенол реагує з бромом з утворенням 2,4,6-трибромофенолу – В
4 амоніачний розчин аргентум(І) оксиду окиснює глюкозу до глюконової кислоти – Б
Відповідь: 1Г, 2А, 3В, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Класи органічних сполук. Характеристичні групи.
Завдання скеровано на перевірку вміння розпізнавати характеристичні групи.
1 гідроксильна група є характеристичною групою спиртів і фенолів – Б
2 аміногрупа є характеристичною групою амінів – Д
3 альдегідна група є характеристичною групою альдегідів – В
4 карбоксильна група є характеристичною групою карбонових кислот – А
Відповідь: 1Б, 2Д, 3В, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості органічних сполук.
Завдання скеровано на перевірку вміння прогнозувати продукти хімічних реакцій за участі органічних сполук.
1 продуктом лужного гідролізу 2-бромопропану є пропан-1-ол – А
2 продуктом ізомеризації бутану є 2-метилпропан – Г
3 продуктом термічного розкладання метану є етин – Б
4 продуктом міжмолекулярної дегідратації метанолу є диметиловий етер – В
Відповідь: 1А, 2Г, 3Б, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Атоми і прості йони. Радіус атома.
Завдання скеровано на перевірку вміння порівнювати радіуси атомів і простих йонів.
Радіуси атомів менші за радіуси відповідних простих аніонів. Зі зростанням протонного числа в головних підгрупах радіуси атомів збільшуються, а в періодах – зменшуються.
Радіус атома Оксигену більший за радіус атома Флуору (обидва – хімічні елементи другого періоду). Радіус атома Сульфуру більший за радіус атома Оксигену (обидва – хімічні елементи VІА групи), а радіус аніона Сульфуру більший за радіус атома цього хімічного елемента.
Радіус частинок збільшується від атома Флуору до аніона Сульфуру в ряду
Відповідь: 1Б, 2А, 3В, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Будова атома. Електронегативність.
Завдання скеровано на перевірку вміння порівнювати електронегативність атомів.
Зі зростанням протонного числа в головних підгрупах електронегативність атомів зменшується, а в періодах – збільшується.
Сульфур і Хлор – елементи третього періоду, протонне число Хлору більше за протонне число Сульфуру, тож електронегативність Хлору також більша.
Сульфур, Селен і Телур – елементи однієї підгрупи, їхні протонні числа збільшуються, а електронегативність зменшується від Сульфуру до Телуру.
Електронегативність збільшується від Телуру до Хлору в ряду елементів
Відповідь: 1В, 2А, 3Б, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати об’єм газу за його кількістю речовини.
Дано:
Знайти:
Відповідь: 112.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масову частку хімічного елемента в речовині за її формулою.
Дано:
Знайти:
Відповідь: 35.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масову частку хімічного елемента в речовині за її формулою.
Дано:
Знайти:
Відповідь: 45.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
1. Знайти:
2. Знайти:
Відповідь: 1. 72. 2. 14.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
1. Знайти:
2. Знайти:
Ізомери складу
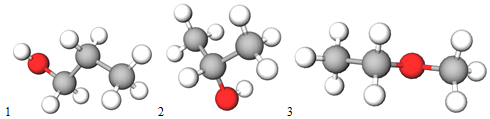
Рис. 1. Ізомери складу
Відповідь: 1. 12. 2. 3.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 48.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів –
Відповідь: 23.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням масу продукту реакції, якщо один із реагентів узято в надлишку.
Дано:
Знайти:
За рівнянням реакції
Тобто сульфатна кислота в надлишку. З натрій гідроксидом кількістю речовини
Маса середньої солі, яка не прореагувала, дорівнює
Відповідь: 71.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Маса склянки з хлоридною кислотою збільшилася за рахунок реакції гідрогенхлориду з етаміном:
Відповідь: 6720.
Знайшли помилку? Пишіть на




