ЗНО онлайн 2015 року з хімії – додаткова сесія
Тестові завдання додаткової сесії ЗНО 2015 року з хімії
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
A молекули цих речовин утворені лише атомами Карбону, Гідрогену, Оксигену, їхній якісний склад однаковий
Б молекули цих речовин утворені різною кількістю атомів Карбону, Гідрогену, Оксигену, їхній кількісний склад різний
В найпростіші формули цих речовин збігаються з їхніми молекулярними формулами, вони різні
Г оскільки молекулярні формули цих речовин різні, то і їхні структурні формули різні
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати природу хімічного елемента за його положенням у періодичній системі.
| Символи металічних елементів | ||
| A | ||
| Б | ||
| B | – | |
| Г | ||
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати місце хімічного елемента в періодичній системі, розрізняти групи, підгрупи, періоди.
Купрум і Калій – металічні елементи першої групи періодичної системи, але належать до різних підгруп. Купрум – хімічний елемент побічної (І Б), а Калій – головної (І А) підгрупи.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку розуміння змісту понять атом, катіон, аніон, протон, електрон, уміння аналізувати склад атомів і простих йонів.
Аніони – негативно заряджені частинки, на які перетворюються атоми внаслідок приєднання електронів. Однозарядний аніон Брому утворюється внаслідок приєднання електрона до атома Брому, кількість протонів в атомі не змінюється:
Катіони – позитивно заряджені частинки, на які перетворюються атоми внаслідок утрачання електронів. Тризарядний катіон Алюмінію утворюється внаслідок утрачання трьох електронів атомом Алюмінію, кількість протонів в атомі не змінюється:
| Частинка | Протонне число | Кількість електронів | |
| A | атом Алюмінію | 13 | 13 |
| Б | атом Брому | 35 | 35 |
| B | катіон Алюмінію | 13 | 10 |
| Г | аніон Брому | 35 | 36 |
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів. Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів з огляду на їхнє місце в періодичній системі.
A Натрій – хімічний елемент І А, а Хлор – VII А групи періодичної системи, в атомі Натрію один, а в атомі Хлору – сім електронів на зовнішньому енергетичному рівні
Б Натрій і Хлор – хімічні елементи третього періоду періодичної системи, електрони в їхніх атомах перебувають на трьох енергетичних рівнях
В Натрій – s-елемент, а Хлор p-елемент, тому кількість енергетичних рівнів, на яких перебувають електрони в їхніх атомах, різна
Г у Натрію і Хлору різні протонні числа, і, відповідно, різні кількості електронів в атомах
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна формула. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
Складниками польового шпату є однозарядні катіони Калію, тризарядні катіони Алюмінію, атоми Силіцію зі ступенем окиснення +4, атоми Оксигену зі ступенем окиснення –2:
Згідно з принципом електронейтральності речовини (сума зарядів складників дорівнює нулю) можна скласти алгебричне рівняння:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Типи кристалічних ґраток.
Завдання скеровано на перевірку вміння прогнозувати тип хімічного зв’язку в речовині за її властивостями.
Літій гідроксид – луг, речовина йонної будови. У вузлах кристалічних ґраток літій гідроксиду містяться катіони Літію і гідроксид-аніони. Те, що водний розчин літій гідроксиду проводить електричний струм, зумовлено дисоціацією літій гідроксиду на йони, які за різниці потенціалів рухатимуться впорядковано.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту понять ступінь окиснення, окисно-відновна реакція, умінь визначати ступені окиснення атомів хімічних елементів за формулами речовин, окисники й відновники.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю.
Окиснення – утрачання електронів атомом або йоном, відновлення – процес, протилежний окисненню.
Окисники приєднують електрони, відновники – віддають.
У процесі відновлення Нітрогену беруть участь вісім електронів.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електроліти й неелектроліти.
Завдання скеровано на перевірку вміння розпізнавати електроліти й неелектроліти.
Електричний струм проводить водний розчин етанової кислоти внаслідок того, що етанова кислота дисоціює на катіони Гідрогену й етаноат-аніони.
Молекула сахарози у водному розчині, гідроген хлорид у бензені не розпадаються на йони. Безводна сульфатна кислота не містить йонів, бо її електролітична дисоціація можлива лише за участі молекул води.
Відповідь: А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
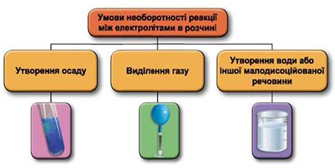
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Осадити катіони Феруму(ІІІ) з водного розчину ферум(ІІІ) нітрату можна гідроксид-аніонами, які утворюються внаслідок електролітичної дисоціації натрій гідроксиду:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати осно́вні, кислотні, амфотерні оксиди й прогнозувати можливість перебігу хімічних реакцій за їхньої участі.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
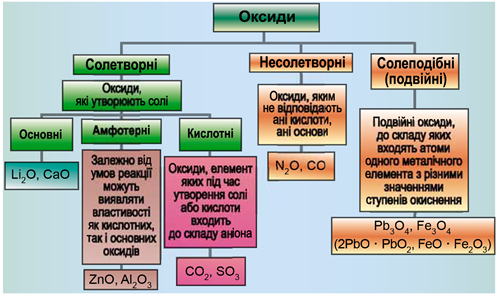
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію (
\(\mathrm{Mg-Ra}\) ) - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
З-поміж оксидів, формули яких наведено в завданні, лише основний магній оксид реагує з хлоридною кислотою і не реагує з натрій гідроксидом.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Нерозчинні основи.
Завдання скеровано на перевірку знання властивостей нерозчинних основ.
Купрум(ІІ) гідроксид – нерозчинна основа, неелектроліт, стійкий до дії окисників, бо Купрум у ньому має максимальний ступінь окиснення.
За нагрівання купрум(ІІ) гідроксид розкладається на купрум(ІІ) оксид і воду:
Купрум(ІІ) гідроксид реагує з хлоридною кислотою з утворенням купрум(ІІ) хлориду й води:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Кислоти. Класифікація кислот за основністю.
Завдання скеровано на перевірку вміння аналізувати хімічні формули кислот і класифікувати їх за основністю.
Основність кислот визначають за кількістю в їхніх молекулах атомів Гідрогену, здатних заміщуватися на атоми металічних елементів.
В молекулі оксалатної кислоти (А) дві карбоксильні групи
В молекулі метанової кислоти (Б) одна карбоксильна група
У молекулах сульфідної (В) і сульфітної (Г) кислот по два атоми Гідрогену, що здатні заміщуватися на атоми металічних елементів.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку знання застосування солей.
Добрива – органічні й неорганічні речовини, які застосовують для поліпшення умов живлення культурних рослин із метою підвищення врожаю і поліпшення його якості. Вони містять поживні елементи – Нітроген, Фосфор, Калій. З-поміж солей, формули яких наведено у варіантах відповіді, умову завдання задовольняє калій нітрат (калійна селітра).
Барій сульфат і купрум(ІІ) сульфід нерозчинні, тому рослини не здатні їх засвоїти. Натрій хлорид згубно впливає на рослини.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Амфотерність.
Завдання скеровано на перевірку розуміння суті амфотерності.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості. Цинк гідроксид реагує як із кислотами, так і з лугами, тобто є амфотерним:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості солей для розпізнавання їх за допомогою якісних реакцій.
З утворенням твердого залишку розкладаються дві солі – цинк нітрат (Б) й натрій гідрогенкарбонат (В). Однак із-поміж них лише цинк нітрат реагує з барій гідроксидом з утворенням осаду амфотерного цинк гідроксиду, який розчиняється як під дією кислоти, так і за надлишку лугу:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку вміння прогнозувати результати перебігу реакцій між металом і сіллю в її водному розчині.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що свинець не витіснятиме із солі залізо, залізо – алюміній, мідь – цинк (рис. 1).

Рис. 1. Ряд активності металів
Цинк як активніший метал витісняє cвинець із солі Плюмбуму(ІІ):
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння аналізувати хімічні рівняння і класифікувати хімічні реакції за різними ознаками.
Реакцію кальцію з водою описують таким хімічним рівнянням:
І реагентами, і продуктами реакції є проста і складна речовини. Це реакція заміщення. Унаслідок реакції виділяється теплова енергія, реакція екзотермічна.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Алюміній. Алюміній гідроксид.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію і способів добування алюміній гідроксиду.
Алюміній реагує з натрій гідроксидом у водному розчині з виділенням водню:
Алюміній гідроксид можна добути реакцією між алюміній хлоридом і натрій гідроксидом у водному розчині:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза та сполук Феруму(ІІ) і Феруму(ІІІ).
Схемі перетворень, наведеній у завданні, відповідають такі хімічні рівняння:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Хлоридна кислота.
Завдання скеровано на перевірку знання властивостей хлоридної кислоти.
Хлоридна кислота реагує з калій гідроксидом (1), цинком (4), аргентум(І) нітратом (5):
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Густина газів.
Завдання скеровано на перевірку розуміння закону Авогадро й уміння застосовувати наслідки з нього.
Рівні об’єми різних газів за однакових умов містять однакову кількість молекул. Молярні об’єми газів за однакових умов рівні, а маса й густина зв’язані співвідношеннями:
Тобто для розв’язання завдання потрібно порівняти відносні молекулярні маси газів, якими заповнювали колби:
Гази, густина яких більша за густину повітря, збирають у посудину, розташовану отвором угору, а гази, густина яких менша за густину повітря, – у посудину, розташовану отвором униз. З огляду на це умову завдання задовольняє лише варіант відповіді Г, бо:
1) метан (варіанти відповіді А й Б) не збирають у посудину, розташовану отвором угору, а кисень (А) і пропан (В) – у посудину, розташовану отвором униз;
2) густина кисню більша, а метану – менша за густину повітря.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Солі амонію.
Завдання скеровано на перевірку вміння застосовувати закон збереження маси речовин для складання хімічних рівнянь.
Рівняння реакції розкладання амоній карбонату таке:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Кислоти. Хлоридна кислота.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій кислот із солями.
Хлоридна кислота сильніша за силікатну, карбонатну й сульфідну кислоти, але слабша за сульфатну. Тому з магній сульфатом хлоридна кислота не реагує. З амоній карбонату хлоридна кислота витісняє карбонатну кислоту, яка розкладається на карбон(IV) оксид і воду. З натрій сульфіду хлоридна кислота витісняє газуватий гідроген сульфід. Унаслідок дії хлоридної кислоти на калій силікат утворюється білий драглистий осад силікатної кислоти:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Систематична номенклатура органічних сполук.
Завдання скеровано на перевірку вміння розпізнавати органічні сполуки різних класів і називати їх за систематичною номенклатурою.
У завданні наведено структурну формулу насиченого одноатомного спирту. Називати спирти за систематичною номенклатурою потрібно за алгоритмом, наведеним на схемі (рис. 1).
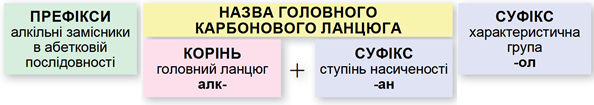
Рис. 1. Алгоритм побудови назв спиртів за систематичною номенклатурою
Важливо пам’ятати:
- потрібно нумерувати карбоновий ланцюг із того кінця, до якого ближче розташована гідроксильна група;
- якщо гідроксильна група рівновіддалена від обох кінців головного карбонового ланцюга, то його нумерують із того кінця, до якого ближче розташований алкільний замісник;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, то його нумерують так, щоби замісник, назву якого за абеткою вживають раніше, був позначений найменшим числом;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, але з одного кінця замісників більше, то нумерацію проводять з урахуванням положення замісників, позначених найменшими числами.
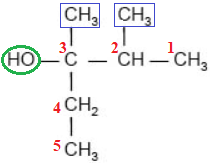
Назва спирту – 2,3-диметилпентан-3-ол.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Способи добування вуглеводнів.
Завдання скеровано на перевірку знання способів добування метану.
На рисунку схематично зображено добування і збирання витісненням повітря метану за хімічним рівнянням
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості алкенів.
Завдання скеровано на перевірку знання хімічних властивостей алкенів, уміння прогнозувати продукти реакцій за їхньої участі.
Продуктом приєднання молекули брому до молекули пропену є молекула 1,2-дибромопропану:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Якісні реакції на органічні сполуки.
Завдання скеровано на перевірку вміння застосовувати знання про якісні реакції на органічні сполуки для їхнього розпізнавання.
Етин від етену можна відрізнити за допомогою амоніачного розчину аргентум(І) оксиду. Зв’язок
Такі сполуки виявляють слабкі кислотні властивості й здатні вступати в реакції заміщення, зокрема заміщувати атом Гідрогену на атом металічного елемента, наприклад:
Етен з аргентум(І) оксидом не реагує.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Якісні реакції на органічні сполуки.
Завдання скеровано на перевірку знання хімічних властивостей органічних сполук.
З-поміж сполук, про які йдеться в завданні, із бромною водою не реагує бензен. Це зумовлено хімічною стійкістю бензенового кільця, у якому шість p-електронів атомів Карбону утворюють стійку ароматичну систему.
У фенолі й аніліні під впливом гідроксильної та аміногрупи відповідно порушується рівномірність розподілу електронної густини в бензеновому кільці, тому ці сполуки знебарвлюють бромну воду внаслідок реакцій заміщення.
Пропін приєднує бром за місцем кратного зв’язку в м’яких умовах, а тому знебарвлює бромну воду.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Природні джерела вуглеводнів.
Завдання скеровано на перевірку знання продуктів нафтоперегонки.
Гас, газойль, бензин – леткі нафтові фракції, складники яких переходять у газуватий стан за порівняно невисоких температур. Мазут – залишок вуглеводнів, що утворюється після відгонки летких вуглеводнів нафти.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Спирти: властивості й способи добування.
Завдання скеровано на перевірку знання хімічних реакцій спиртів і способів їхнього добування.
Метанол у промисловості добувають синтезом із карбон(ІІ) оксиду й водню:
Продуктом часткового окиснення метанолу є метаналь:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Ненасичені органічні сполуки. Оксигеновмісні органічні сполуки.
Завдання скеровано на перевірку розуміння поняття «ненасичені органічні сполуки» та знання хімічних властивостей карбонових кислот.
У молекулі акрилової кислоти є подвійний зв'язок між атомами Карбону, тому це ненасичена органічна сполука.
Також у молекулі цієї речовини є характеристична карбоксильна група, тому вона реагує зі спиртами з утворенням естерів.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Естери. Жири.
Завдання скеровано на перевірку знання хімічного складу й властивостей естерів і жирів.
Жири – естери триатомного спирту гліцеролу й вищих карбонових кислот. Тож продуктами кислотного гідролізу жирів є гліцерол і вищі карбонові кислоти.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи. Хімічні реакції в органічній хімії.
Завдання скеровано на перевірку знання хімічних властивостей целюлози й типів хімічних реакцій за її участі.
Реакція нітрування целюлози відбувається за характеристичними гідроксильними групами в її молекулах. Це реакція естерифікації.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки.
Завдання скеровано на перевірку знання номенклатури й хімічних властивостей амінів.
Як етиламін, так і диметиламін належать до аліфатичних амінів, горять на повітрі й реагують із хлоридною кислотою з утворенням солей. Однак диметиламін містить два вуглеводневі замісники біля атома Нітрогену й тому є сильнішою органічною основою.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Високомолекулярні органічні сполуки.
Завдання скеровано на перевірку розуміння суті реакції поліконденсації.
З-поміж речовин, формули яких наведено в завданні, у реакцію поліконденсації вступає речовина, молекула якої містить дві характеристичні групи, здатні реагувати одна з одною – карбоксильну й аміногрупу.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
1 у реакцію сполучення вступає кілька речовин, утворюється одна складна речовина, під час екзотермічної реакції теплова енергія виділяється – Г
2 у реакцію сполучення вступає кілька речовин, утворюється одна складна речовина, під час ендотермічної реакції теплова енергія поглинається – B
3 у реакцію розкладання вступає одна складна речовина, утворюється кілька речовин, під час екзотермічної реакції теплова енергія виділяється – Д
4 у реакцію розкладання вступає одна складна речовина, утворюється кілька речовин, під час ендотермічної реакції теплова енергія поглинається – Б
Відповідь: 1Г, 2В, 3Д, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних речовин.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій за участі неорганічних речовин.
1 карбон(ІІ) оксид є сильним відновником, реагує з киснем і ферум(ІІІ) оксидом – B
2 натрій гідрогенкарбонат є кислою сіллю слабкої кислоти, реагує як із натрій гідроксидом, так і з хлоридною кислотою – Г
3 основний кальцій оксид реагує з водою і з кислотним оксидом – Б
4 купрум(ІІ) нітрат реагує із цинком як активнішим за мідь металом, і з лугом з утворенням нерозчинного купрум(ІІ) гідроксиду – А
Відповідь: 1В, 2Г, 3Б, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних речовин.
Завдання скеровано на перевірку вміння класифікувати неорганічні речовини за їхніми формулами.
1 складна речовина, утворена атомами Гідрогену, здатними заміщуватися атомами металічних елементів, й аніонами залишку силікатної кислоти – кислота – Г
2 розчинна складна речовина утворена катіонами барію і гідроксид-аніонами – луг – В
3 продукт неповного заміщення атомів Гідрогену в молекулі ортофосфатної кислоти на атоми Калію – кисла сіль – А
4 бінарна сполука металічного елемента з киснем, у якій ступінь окиснення Оксигену становить –2, реагує як із лугами, так і з кислотами – Б
Відповідь: 1Г, 2В, 3А, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Класифікація реакцій в органічній хімії.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за участі органічних сполук.
1 бромування алканів є реакцією заміщення – Г
2 етин приєднує гідроген хлорид – А
3 унаслідок реакції бромоетану зi спиртовим розчином лугу утворюється етен – Д
4 купрум(ІІ) гідроксид окиснює етаналь до етанової кислоти – Б
Відповідь: 1Г, 2А, 3Д, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Класи органічних сполук. Характеристичні групи.
Завдання скеровано на перевірку вміння розпізнавати характеристичні групи.
1 карбоксильна група є характеристичною групою карбонових кислот – Б
2 гідроксильна група є характеристичною групою спиртів і фенолів – В
3 аміногрупа є характеристичною групою амінів – А
4 альдегідна група є характеристичною групою альдегідів – Д
Відповідь: 1Б, 2В, 3А, 4Д.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості органічних сполук.
Завдання скеровано на перевірку вміння прогнозувати продукти хімічних реакцій за участі органічних сполук.
1 фенол реагує з бромною водою – В
2 етанова кислота реагує з натрій карбонатом – А
3 метиламін реагує з хлоридною кислотою – Б
4 продуктом внутрішньомолекулярної дегідратації етанолу є етен – Г
Відповідь: 1В, 2А, 3Б, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів.
Завдання скеровано на перевірку вміння порівнювати будову зовнішніх енергетичних рівнів атомів.
На зовнішньому енергетичному рівні в атомах лужних елементів (І А група) один s-електрон, в атомах лужноземельних (ІІ А група) – два s-електрони, в атомах галогенів (VІІ А група) – два s-електрони і п’ять p-електронів, в атомах інертних елементів (VІІІ А група) – два s-електрони і шість p-електронів (за винятком атома Гелію, у якому на зовнішньому енергетичному рівні два s-електрони).
Кількість електронів на зовнішньому енергетичному рівні збільшується в ряду
Відповідь: 1В, 2Г, 3А, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів. Електронегативність.
Завдання скеровано на перевірку вміння порівнювати електронегативність хімічних елементів за їхнім місцем у періодичній системі.
Зі зростанням протонного числа в головних підгрупах електронегативність атомів зменшується, а в періодах – збільшується. Електронегативність Оксигену більша за електронегативність Нітрогену (обидва – хімічні елементи другого періоду). Електронегативність Нітрогену більша за електронегативність Фосфору, а Фосфору – більша ніж електронегативність Арсену (усі – хімічні елементи V А групи).
Електронегативність збільшується від Арсену до Оксигену в ряду елементів
Відповідь: 1А, 2Г, 3B, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння порівнювати будову зовнішніх енергетичних рівнів атомів.
Завдання скеровано на перевірку вміння обчислювати кількість атомів хімічних елементів у молекулах алкенів за загальною формулою вуглеводнів цього гомологічного ряду.
Загальна формула вуглеводнів гомологічного ряду алкенів
Відповідь: 6.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати кількість речовини хімічного елемента за масою сполуки.
Дано:
Знайти:
Відповідь: 3.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 252.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
1. Знайти:
2. Знайти:
Відповідь: 1. 2. 2. 128.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
1. Знайти:
2. Знайти:
Ізомери складу
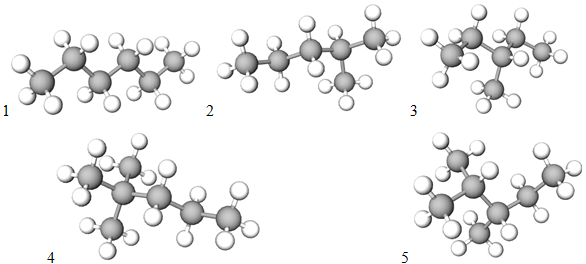
Рис. 1. Ізомери складу
Відповідь: 1. 20. 2. 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносний вихід продукту реакції.
Дано:
Знайти:
Відповідь: 50.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
За рівнянням реакції
Відповідь: 324.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів –
Відповідь: 17.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням масу продукту реакції, якщо один із реагентів узято в надлишку.
Дано:
Знайти:
За рівнянням реакції
Тобто ортофосфатна кислота в надлишку. З натрій гідроксидом кількістю речовини
Тому з ортофосфатною кислотою кількістю речовини
Відповідь: 41.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Маса склянки з бромною водою збільшилася за рахунок реакції брому з етином:
Відповідь: 48.
Знайшли помилку? Пишіть на




