ЗНО онлайн 2016 року з хімії – основна сесія
Тестові завдання основної сесії ЗНО 2016 року з хімії
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
Молекулярні формули речовин, про які йдеться в завданні, різні, тому їхні найпростіші та структурні формули не можуть бути однаковими.
Якісний склад у цих речовин однаковий, бо їхні молекулярні формули містять однакові набори символів хімічних елементів, натомість кількісний склад різний, бо індекси біля символів Гідрогену й Оксигену різні.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за електронною будовою енергетичних рівнів їхніх атомів.
В атомах d-елементів заповнюється електронами зовнішній d-підрівень (рис. 1).
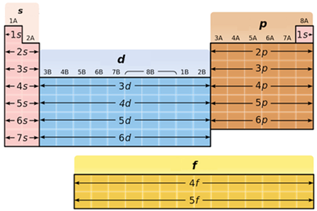
Рис. 1. Положення s-, p-, d-, f-елементів у періодичній системі
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Радіус атома.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і радіус атома.
У поданому ряду хімічних елементів збільшуються їхні протонні числа. Тому з огляду на електронейтральність атомів загальна кількість електронів на зовнішньому енергетичному рівні також збільшується.
Кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп дорівнює номеру групи й у поданому ряду хімічних елементів збільшується.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується. Подані елементи належать до одного періоду, тому зі збільшенням протонного числа їхня електронегативність збільшується.
Атомний радіус – половина віддалі, на якій перебувають сусідні атоми в структурі простої речовини. Величина залежить від алотропної видозміни елемента. Також атомним радіусом називають половинну відстань між ядрами атомів того самого елемента, коли атоми зв’язані одинарним ковалентним зв’язком або перебувають у кристалі металу. У періодах зі збільшенням протонних чисел атомні радіуси зменшуються, у групах хімічних елементів – збільшуються (рис. 1). Подані елементи належать до одного періоду, тому зі збільшенням протонного числа збільшується електронегативність атомів.
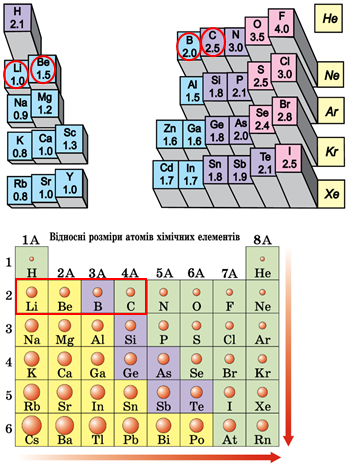
Рис. 1. Закономірності зміни електронегативності й радіуса атомів хімічних елементів у періодичній системі
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Будова атома. Йони.
Завдання скеровано на перевірку вміння аналізувати склад атомів і простих йонів.
Електронна формула атома Натрію
Катіон
Електронна формула атома Флуору
Аніон
| Частинка | Кількість | |||
| протонів |
нуклонів |
нейтронів |
електронів | |
| 11 | 23 | 12 | 10 | |
| 9 | 19 | 10 | 10 | |
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Йони.
Завдання скеровано на перевірку вміння аналізувати хімічні формули.
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку вміння розпізнавати речовини йонної будови.
Йонний зв’язок – хімічний зв’язок електростатичної природи між атомами чи групою атомів із дуже великою рiзницею в електронегативності. Валентний електрон при цьому переходить до атома з більшою електронегативністю, а утворені йони притягаються електростатичними силами.
Тобто йонний зв’язок – це зв’язок між йонами.
У варіантах відповіді А, В, Г є формули речовин, утворених атомами неметалічних елементів із порівняно невеликою різницею електронегативності. Тому вони не задовольняють умову завдання. У варіанті відповіді Б наведено формули сполук металічних елементів із неметалічними. У цих елементів значна різниця електронегативності, що зумовлює утворення йонного зв’язку між катіонами лужних елементів – Натрію і Калію – й аніонами Хлору, Оксигену, Сульфуру (рис. 1).
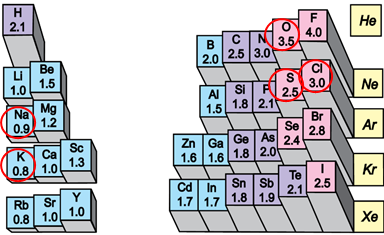
Рис. 1. Відносна електронегативність атомів хімічних елементів
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин і складних йонів, визначати кількість відданих або прийнятих під час окисно-відновних реакцій електронів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Відповідь: А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Розчини. Розчинність речовин.
Завдання скеровано на перевірку знання залежності розчинності речовин від різних чинників.
Розчинність – максимальна маса речовини, яка може за певних умов (температури, тиску) розчинитися в розчиннику масою 100 г. Розчинність залежить від природи розчинюваної речовини та розчинника, температури й (для газуватих речовин) тиску.
Розчинність газів із підвищенням температури зменшується, зі збільшенням тиску – збільшується.
Відповідь: А.
Знайшли помилку? Пишіть на
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
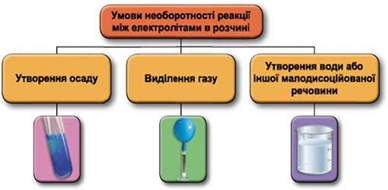
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині не реагують барій сульфат і хлоридна кислота – летка хлоридна кислота не витісняє сильну нелетку сульфатну кислоту з її солі – нерозчинного барій сульфату (рис. 2).
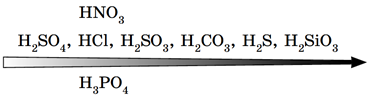
Рис. 2. Витискувальний ряд кислот
У решті поданих варіантів відповіді внаслідок перебігу реакцій між речовинами в розчинах утворюються осади силікатної кислоти (А), ферум(ІІ) гідроксиду (В), барій карбонату (Г).
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати осно́вні, кислотні, амфотерні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
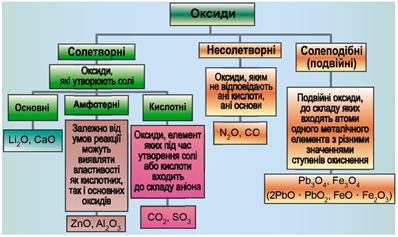
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\((\mathrm{Mg\ –\ Ra})\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO, FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Літій оксид – основний, цинк оксид – амфотерний, карбон(IV) оксид – кислотний.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Способи добування нерозчинних основ.
Завдання скеровано на перевірку знання способів добування неорганічних речовин.
Нерозчинні основи добувають реакціями обміну між лугом і сіллю в розчині:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Класифікація кислот.
Критерій класифікації кислот за основністю – кількість атомів Гідрогену, здатних заміститися на атоми металічного елемента. У молекулах одноосновних кислот один атом Гідрогену здатен заміститися атомом металічного елемента, у молекулах двоосновних кислот два атоми Гідрогену здатні заміститися атомами металічного елемента (рис. 1).
Двоосновними є сульфітна
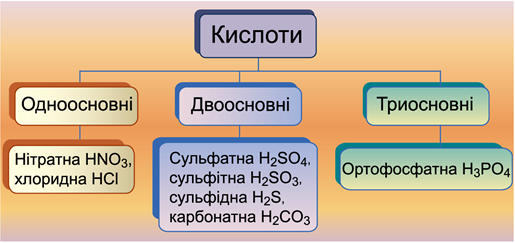
Рис. 1. Класифікація кислот за основністю
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Способи добування солей.
Завдання скеровано на перевірку знання способів добування неорганічних речовин.
Добування середніх солей ґрунтується переважно на взаємодії речовин із протилежними властивостями, зокрема:
- основного або амфотерного оксиду з кислотою (1);
- солі слабшої і / або леткішої кислоти із сильнішої і / або менш леткою кислотою (2);
- основи з кислотою (6).
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Солі. Реакції обміну між електролітами у розчині. Явище амфотерності.
Завдання скеровано на перевірку вміння визначати можливість перебігу реакції обміну між електролітами в розчині.
Якщо в кожну пробірку добавляти краплями водний розчин натрій гідроксиду спочатку в обох пробірках утворяться осади нерозчинних гідроксидів. Магній гідроксид осно́вний, тому з надлишком лугу не реагуватиме. Натомість осад амфотерного алюміній гідроксиду в надлишку лугу розчиниться.
Суть реакцій, що відбулися, можна описати за допомогою скорочених йонних рівнянь:
Відповідь: А.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Реакції обміну між електролітами у розчині.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій обміну між електролітами в розчині, продукти цих реакцій.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
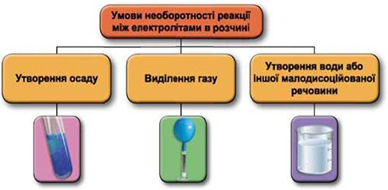
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє натрій карбонат:
Сильна хлоридна кислота витісняє слабку й нестійку карбонатну кислоту з її солі (рис. 2).
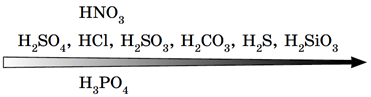
Рис. 2. Витискувальний ряд кислот
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
Порівнявши положення металів у ряду активності (рис. 1), можна дійти висновку, що цинк витіснятиме із солей свинець (В) і нікель (Г), оскільки в ряду активності він розташований лівіше:
Активніші метали – барій (А) і кальцій (Б), які в ряду активності розташовані лівіше за цинк, він із розчинів солей витіснити не зможе.

Рис. 1 Ряд активності металів
Атомна маса Плюмбуму більша за атомну масу Цинку, тому маса пластинки збільшилася.

Тобто умову завдання задовольняє лише плюмбум(ІІ) нітрат.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Тимчасову (карбонатну) твердість води зумовлено катіонами
Відповідь: А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Окисно-відновні реакції. Алюміній.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію, уміння визначати ступені окиснення хімічних елементів за формулами речовин, кількість відданих або прийнятих під час окисно-відновних реакцій електронів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза, уміння прогнозувати продукти реакцій за його участі.
Залізо реагує з перегрітою водяною парою:
Газуватим продуктом реакції є малорозчинний у воді газ водень, який зібрають витісненням її.
Сума коефіцієнтів:
Відповідь: А.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Галогени.
Завдання скеровано на перевірку знання хімічних властивостей галогенів, уміння порівнювати їхню активність.
Хімічна активність й окиснювальна здатність галогенів (атомів і молекул) спадає в ряду від Флуору до Йоду. Активніші галогени витісняють менш активні з їхніх сполук:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Окисно-відновні реакції. Сульфур.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію, уміння визначати ступені окиснення хімічних елементів за формулами речовин, кількість відданих або прийнятих під час окисно-відновних реакцій електронів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
А
Б
В
Г
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Добування амоніаку.
Завдання скеровано на перевірку знання способів добування неорганічних речовин, тривіальних назв деяких із них.
Нашатир – тривіальна назва амоній хлориду
Амоніак
Густина амоніаку менша за густину повітря, тому його збирають витісненням останнього з пробірки, розташованої догори дном.
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Органічна хімія. Алкани. Карбон(IV) оксид.
Завдання скеровано на перевірку знання хімічних властивостей алканів і карбон(IV) оксиду, якісної реакції на карбон(IV) оксид.
Реактивом на карбон(IV) оксид є вапняна вода:
Унаслідок пропускання карбон(IV) оксиду крізь неї утворюється білий осад кальцій карбонату.
Пропан як представник алканів із кальцій гідроксидом не реагує.
Відповідь: А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура амінів.
Завдання скеровано на перевірку вміння називати аміни за систематичною номенклатурою.
Алгоритм називання амінів за систематичною номенклатурою зображено на рисунку 1.
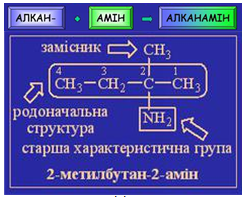
Рис. 1. Алгоритм називання амінів за систематичною номенклатурою
Назва органічної сполуки, структурну формулу якої наведено в завданні, – 3-метилгексан-3-амін (рис. 2).
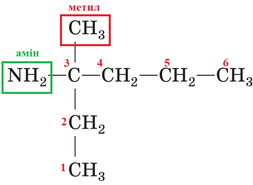
Рис. 2. Структурна формула 3-метилгексан-3-аміну
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкани. Метан.
Завдання скеровано на перевірку знання поширення в природі, фізичних і хімічних властивостей метану.
1 метан за освітлення вступає із хлором у реакцію заміщення
2 метан – головний складник природного газу
3 метан є насиченим вуглеводнем і не знебарвлює бромну воду
4 взаємодією кальцій карбіду з водою добувають ацетилен
5 метан
6 молярна маса метану 16, а середня молярна маса повітря 29
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкени. Типи хімічних реакцій в органічній хімії.
Завдання скеровано на перевірку знання хімічних властивостей алкенів і вміння класифікувати хімічні реакції за їхньої участі.
Пропен є ненасиченим вуглеводнем, тому вступає в реакції приєднання, зокрема з бромом:
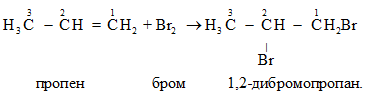
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкіни. Етин.
Завдання скеровано на перевірку знання хімічних властивостей алкінів, способу добування етаналю.
Зв’язок
Такі сполуки виявляють слабкі кислотні властивості й здатні вступати в реакції заміщення, зокрема заміщувати атом Гідрогену на атом металічного елемента, наприклад,
Продуктом каталітичної гідратації етину є етаналь (реакція Кучерова):
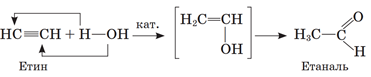
Відповідь: А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкани. Бензен.
Завдання скеровано на перевірку знання хімічних властивостей алканів і генетичних зв’язків між вуглеводнями різних груп.
Сума коефіцієнтів:
Відповідь: А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між органічними речовинами різних класів.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
Продуктом окиснення етанолу
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між органічними речовинами різних класів.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
Продуктами окиснення альдегідів є карбонові кислоти:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між органічними речовинами різних класів. Естери.
Завдання скеровано на перевірку розуміння суті реакції естерифікації, уміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
У завданні наведено структурну формулу етилового естеру 2-метилпропанової кислоти:
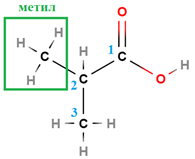 |
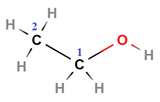 |
 |
| 2-Метилпропанова кислота | Етанол | Етил-2-метилпропаноат |
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи. Целюлоза.
Завдання скеровано на перевірку знання властивостей вуглеводів, зокрема целюлози.
Целюлоза – аморфна волокниста речовина, нерозчинна у воді й органічних розчинниках. На відміну від крохмалю не набуває синього забарвлення під дією водно-спиртового розчину йоду.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Амінокислоти. Білки.
Завдання скеровано на перевірку знання суті кольорових реакцій за участі білків.
Біуретова реакція – якісна реакція на все без винятку білки, а також продукти їхнього неповного гідролізу, які містять не менше двох пептидних зв’язків. Біуретова реакція зумовлена пептидними зв’язками в молекулах білків, які в лужному середовищі утворюють із купрум(ІІ) сульфатом забарвлені сполуки.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між органічними речовинами різних класів.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
Продуктом термічного розкладання метану за температури 1 500 °C є етин (1). Продуктом його каталітичної гідратації – етаналь (X), який окиснено купрум(ІІ) гідроксидом до етанової кислоти (2):
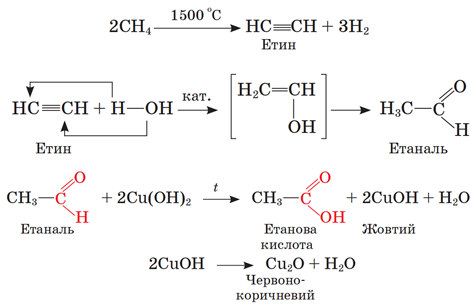
Відповідь: А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати представників різних класів неорганічних сполук.
| 1 | барій сульфіт |
A |
| 2 | боратна кислота |
Г |
| 3 | амоній гідрогенкарбонат |
Д |
| 4 | кальцій оксид |
Б |
Відповідь: 1А, 2Г, 3Д, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Будова атома. Йони.
Завдання скеровано на перевірку вміння аналізувати склад атомів і простих йонів.
Усі хімічні елементи, про які йдеться в завданні, розташовані в третьому періоді, тобто електрони в їхніх атомах розподілено за трьома енергетичними рівнями. Натрій – хімічний елемент 1А групи, Магній – 2А, Силіцій – 4А, Хлор – 7А. На зовнішньому енергетичному рівні в їхніх атомах міститься відповідно 1, 2, 4 і 7 електронів.
| 1 | Протонне число Магнію 12, тобто 12 електронів в його атомі розподілено по трьох енергетичних рівнях. У двозарядному катіоні Магнію на два електрони менше: |
Д |
| 2 | Протонне число Хлору 17, тобто 17 електронів в його атомі розподілено по трьох енергетичних рівнях. В однозарядному аніоні Хлору на електрон більше: |
A |
| 3 | Протонне число Натрію 11, тобто 11 електронів в його атомі розподілено по трьох енергетичних рівнях: |
Г |
| 4 | Протонне число Силіцію 14, тобто 14 електронів в його атомі розподілено по трьох енергетичних рівнях: |
B |
Відповідь: 1Д, 2А, 3Г, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Класи органічних сполук.
Завдання скеровано на перевірку вміння класифікувати органічні речовини.
| 1 | Етиленгліколь | 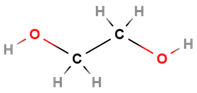 |
Двоатомний спирт | Б |
| 2 | Анілін | 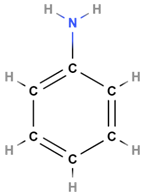 |
Ароматичний амін | A |
| 3 | Гліцин | 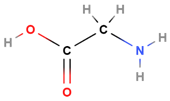 |
Амінокислота | Д |
| 4 | Бутаналь | 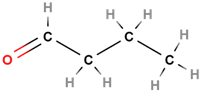 |
Альдегід | Г |
Відповідь: 1Б, 2А, 3Д, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Назви органічних речовин різних класів.
Завдання скеровано на перевірку знання назв органічних речовин різних класів.
| 1 | B | |
| 2 | A | |
| 3 | Г | |
| 4 | Д |
Відповідь: 1В, 2А, 3Г, 4Д.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Властивості органічних речовин.
Завдання скеровано на перевірку вміння прогнозувати продукти реакцій за участю органічних речовин.
1. Унаслідок гідратації ацетилену утворюється етаналь (Б):
.
2. Унаслідок міжмолекулярної дегідратації етанолу утворюється діетиловий етер (В):
.
3. Унаслідок відновлення хлоробензолу (хлоробензену) утворюється фенол (А):
.
4. Унаслідок відновлення нітробензену утворюється анілін (Д):
.
Відповідь: 1Б, 2В, 3А, 4Д.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Типи хімічних реакціях в органічній хімії.
Завдання скеровано на перевірку вміння розпізнавати типи реакцій за участі органічних речовин.
| 1 | Ізомеризація бутану в ізобутан – речовину з таким самим складом, але іншою будовою молекули | Г |
| 2 | Під час бромування ізобутану атом Гідрогену біля другого атома Карбону заміщується на атом Брому | А |
| 3 | Перетворення 2-бромо-2-метилпропану на 2-метилпроп-1-ен супроводжується відщепленням молекули гідроген броміду | В |
| 4 | Унаслідок повного окиснення 2-метилпроп-1-ену утворюються карбон(ІV) оксид і вода | Д |
Відповідь: 1Г, 2А, 3В, 4Д.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Аміни.
Амоніак й аміни виявляють осно́вні властивості через наявність в атома Нітрогену неподіленої електронної пари. Під час взаємодії з кислотами вони утворюють амонієві солі:
Основні властивості в аліфатичних амінів через вплив вуглеводневих замісників виражені сильніше, ніж в амоніаку. У вторинних вони виявляються сильніше, ніж у первинних.
Анілін виявляє слабші порівняно з аліфатичними амінами й амоніаком основні властивості. Це зумовлено впливом на аміногрупу бензенового ядра:
Тобто основні властивості речовин посилюються в ряду
Відповідь: 1Г, 2Б, 3А, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Масова частка хімічного елемента.
Завдання скеровано на перевірку розуміння змісту поняття «масова частка хімічного елемента».
Масова частка хімічного елемента – відношення маси хімічного елемента в речовині до маси речовини.
Маса Феруму в усіх речовинах, формули яких наведено, та сама. Тобто потрібно порівняти маси решти хімічних елементів у речовинах.
| А | 16 | 4 | |
| Б | 32+16· 4 | 1 | |
| В | 2· 35,5 | 2 | |
| 4 | 35· 2 | 3 |
Відповідь: 1Б, 2В, 3Г, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу газової суміші.
Дано:
Знайти:
Відповідь: 37.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 50.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну густину газу.
Дано:
Знайти:
Відповідь: 16.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння виводити молекулярну формулу речовини.
Дано:
1. Знайти:
2. Знайти:
Відповідь: 1. 56. 2. 12.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати маси / об’єми реагентів і продуктів реакцій за хімічними рівняннями.
Дано:
1. Знайти:
2. Знайти:
Відповідь: 1. 2240. 2. 4480.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою окисника – 3.
Відповідь: 3.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 30.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 60.
Знайшли помилку? Пишіть на




