ЗНО онлайн 2017 року з хімії – пробний тест
Тестові завдання пробного тесту ЗНО 2017 року з хімії
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
У цих речовин однаковий якісний склад – їхні молекули утворені атомами трьох хімічних елементів – Карбону, Гідрогену, Оксигену. Оскільки кількісний склад різний, то різними є і найпростіша, і структурна формули цих сполук.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за електронною будовою зовнішнього енергетичного рівня їхніх атомів.
В атомах p-елементів заповнюється електронами зовнішній p-підрівень (рис. 1).
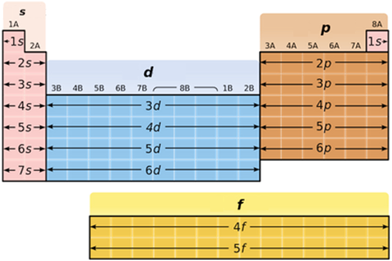
Рис. 1. Положення s-, p-, d-, f-елементів у періодичній системі
До p-елементів належать елементи головних (A) підгруп ІІІ–VIII груп періодичної системи – Флуор, Хлор, Бром, будова зовнішнього енергетичного рівня яких така:
| n = | 2, | 3, | 4 |
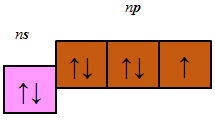
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння аналізувати склад атомів.
Вочевидь, в умові завдання ідеться про атом Сульфуру, кількість електронів у якому становить 16 – шість s- і 10 p-електронів (рис. 1). Те, що в атомі хімічного елемента шість s-електронів, означає, що в його атомі електрони перебувають на трьох енергетичних рівнях, оскільки максимальна кількість s-електронів на одному енергетичному рівні дорівнює двом. Відповідно кількість p-електронів на другому енергетичному рівні – шість, на третьому – чотири (рис. 1). На зовнішньому енергетичному рівні в атомі цього хімічного елемента шість електронів – два s- і чотири p-електрони.
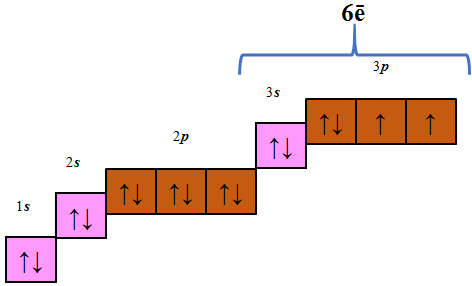
Рис. 1. В атомі Сульфуру шість s-
 і десять p-електронів
і десять p-електронів 
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічний зв’язок. Будова речовини.
Завдання скеровано на перевірку вміння розпізнавати речовини йонної будови.
Йонний зв’язок – хімiчний зв’язок електростатичної природи між атомами чи групою атомiв із дуже великою рiзницею в електронегативностях. На відміну від ковалентного зв’язку, валентний електрон при цьому переходить до атома з більшою електронегативністю, а утворені йони притягаються електростатичними силами.
Тобто йонний зв’язок – це зв’язок між йонами.
У речовинах, формули яких наведено у варіантах відповіді Б, В, сполучені атоми неметалічних елементів із порівняно невеликою різницею електронегативностей, у варіанті Г – атоми того самого неметалічного елемента. Натомість у натрій оксиді велика різниця електронегативностей зумовлює утворення йонного зв’язку між катіонами лужного елемента Натрію й аніонами Оксигену.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки.
Завдання скеровано на перевірку розуміння змісту поняття кристалічні ґратки, уміння розпізнавати речовини з певним типом кристалічних ґраток за їхніми фізичними властивостями.
В атомних кристалах атоми зв’язані ковалентним неполярним зв’язком. Характерним прикладом таких речовин є алмаз, у кристалічних ґратках якого всі щонайближчі між’ядерні відстані й усі кути між чотирма зв’язками атома Карбону рівні (рис. 1).
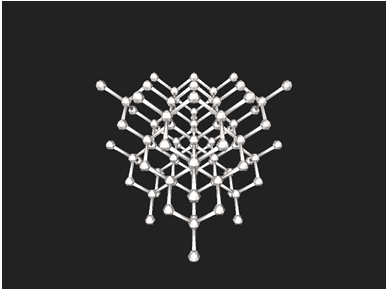
Рис. 1. Кристалічні ґратки алмазу
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
А
Б
В
Г
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
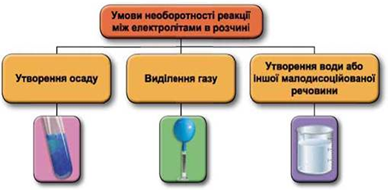
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Барій хлорид (А), на відміну від магній хлориду (Б), не реагує з натрій гідроксидом у водному розчині, оскільки всі речовини залишаються у формі йонів (рис. 2).
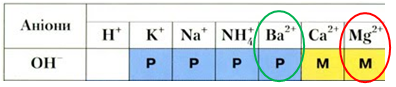
Рис. 2. Барій гідроксид – розчинна речовина, натомість магній гідроксид малорозчинний
Сильна й нелетка сульфатна кислота витісняє слабку й летку карбонатну з її солі (В), а сильна нітратна кислота – слабку сульфітну. Також можливе окиснення сульфітної кислоти до сульфатної (Г).
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
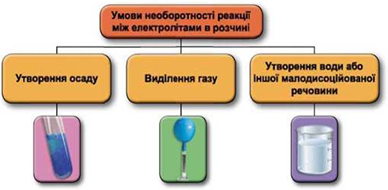
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Осадити карбонат-аніони з водного розчину можна за допомогою розчину барій хлориду (рис. 2).
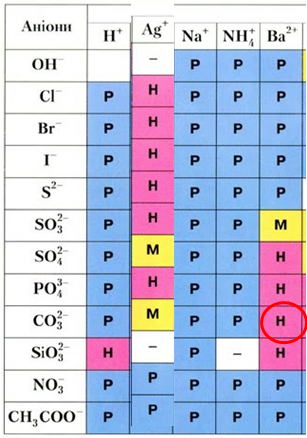
Рис. 2. Барій карбонат утворюється внаслідок осадження карбонат-аніонів катіонами Барію
Унаслідок дії сульфатної та етанової кислот на карбонат-аніони виділяється газ – карбон(ІV) оксид, тобто про осадження не йдеться. Натрій карбонат є розчинною речовиною, тож осадити карбонат-аніони за допомогою розчину натрій хлориду не можна. Натомість барій карбонат є нерозчинною речовиною, тому для осадження карбонат-аніонів можна використати водний розчин барій хлориду.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
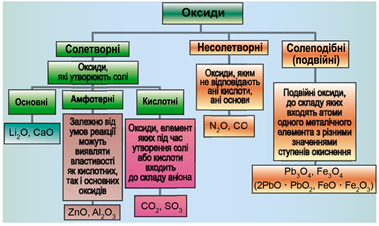
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\((\mathrm{Mg\ –\ Ra})\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO, FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Алюміній оксид – амфотерний.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Луги й нерозчинні основи.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості нерозчинних основ і лугів.
І. За нагрівання нерозчинні основи розкладаються з утворенням оксиду металічного елемента й води:
ІI. Взаємодія активних металів з водою – один зі способів добування лугів:
ІII. У розчинах лугів індикатори змінюють своє забарвлення. У розчинах лугів фенолфталеїн набуває малинового забарвлення, він є специфічним індикатором лужного середовища:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Сульфатна кислота.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості сульфатної кислоти для прогнозування можливості перебігу хімічних реакцій за її участю.
1. У сульфатній кислоті атом Сульфуру перебуває в найвищому ступені окиснення +6 і тому не може бути окиснений. Тож сульфатна кислота не реагує з киснем.
2. Амоніак реагує із сульфатною кислотою з утворенням кислої або середньої солі:
3. Магній оксид осно́вний, тому реагує із сульфатною кислотою:
4. Карбон(IV) оксид є кислотним (не реагує з кислотами) і не може бути відновником (бо атом Карбону у найвищому ступені окиснення не може віддавати електрони й окиснюватися).
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Солі. Застосування солей.
Завдання скеровано на перевірку знання застосування солей.
Добрива – органічні й неорганічні речовини, які застосовують для поліпшення умов живлення культурних рослин з метою підвищення врожаю і поліпшення його якості. Вони містять поживні елементи – Нітроген, Фосфор, Калій. З-поміж солей, формули яких наведено у варіантах відповіді, умову завдання задовольняє амоній нітрат (амонійна селітра).
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Амфотерність.
Завдання скеровано на перевірку розуміння суті амфотерності.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості. Оксиди й гідроксиди Барію, Кальцію, Стронцію виявляють осно́вні властивості й реагують з кислотами. Цинк оксид і цинк гідроксид реагують як з кислотами, так і з лугами, тобто є амфотерними:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Якісні реакції на деякі йони.
Завдання скеровано на перевірку вміння застосовувати знання про якісні реакції на деякі йони для розрізнення розчинів речовин.
Обидві солі містять катіон Магнію, тому розрізнити їх можна лише за аніонами. Реактивом на сульфат-аніон є катіон Барію, унаслідок їхньої взаємодії утворюється нерозчинний барій сульфат. Натомість барій хлорид є розчинною речовиною (рис. 1).
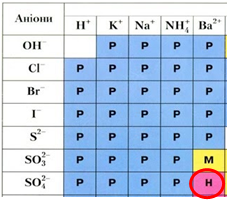
Рис. 1. Реактивом на сульфат-аніон є катіон Барію
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Застосування оксидів. Окисники й відновники.
Завдання скеровано на перевірку знання властивостей і застосування неорганічних речовин.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
Карбон(IV) оксид, силіцій(IV) оксид, сульфур(VI) оксид є вищими оксидами, атоми
У карбон(ІІ) оксиді атом Карбону
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Амфотерність.
Завдання скеровано на перевірку розуміння суті амфотерності, уміння пояснювати результати дослідів.
Алюміній гідроксид – нерозчинна у воді сполука, тому його можна добути реакцією обміну між розчинною сіллю Алюмінію і лугом у водному розчині:
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості. З кислотами алюміній гідроксид
Тому осад алюміній гідроксиду розчиняється і в кислоті, і в лугу:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза, зокрема його взаємодії із хлоридною кислотою і хлором, і сполук Феруму(ІІ) і Феруму(ІІІ).
Потрібно взяти до уваги, що в реакціях із сильними окисниками (молекули хлору) утворюються сполуки Феруму(ІІІ), а з натрій хлориду у водному розчині залізо не може витіснити натрій (рис. 1). Тому варіанти відповіді Б і Г не задовольняють умову завдання.
Як активніший метал залізо витісняє мідь із купрум(ІІ) хлориду у водному розчині й водень з хлоридної кислоти:
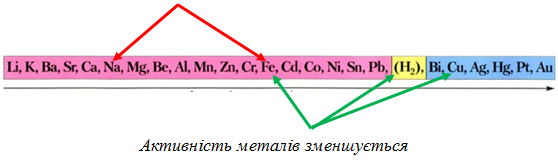
Рис. 1. Залізо не витісняє натрій з натрій хлориду у водному розчині. Натомість витісняє мідь з купрум(ІІ) хлориду й водень із хлоридної кислоти
Сполуки Феруму(ІІІ) утворюються внаслідок дії на сполуки Феруму(ІІ) окисників. Тобто умову завдання задовольняє варіант відповіді A:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Умовою необоротності перебігу реакцій між електролітами у водному розчині є утворення води, осаду, виділення газу.
A
Б
B
Г
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисники й відновники. Хімічні властивості сірки.
Завдання скеровано на перевірку знання хімічних властивостей сірки й уміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
Електронегативність Сульфуру більша за електронегативність Гідрогену й Магнію і менша порівняно з електронегативністю Флуору й Оксигену (рис. 1). Тому окисником сірка – проста речовина Сульфуру – може бути з воднем і магнієм і не може – із фтором й киснем.
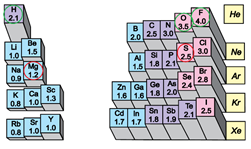
Рис. 1. Відносна електронегативність атомів хімічних елементів
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Ступінь окиснення. Окисники й відновники. Хімічні властивості амоніаку.
Завдання скеровано на перевірку знання хімічних властивостей амоніаку й уміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
A
Б
B
Г
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Карбон(ІV) оксид.
Завдання скеровано на перевірку знання способів добування карбон(ІV) оксиду.
Карбон(ІV) оксид добувають дією кислот, сильніших за карбонатну, на її солі:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Ізомерія.
Завдання скеровано на перевірку розуміння суті ізомерії й уміння аналізувати хімічний склад органічних речовин за їхніми структурними формулами.
Ізомери – речовини з однаковою молекулярною формулою, але різною будовою молекул.
Структурними ізомерами є пропен і циклопропан. За однакової молекулярної формули вони мають різну будову молекул (рис. 1).
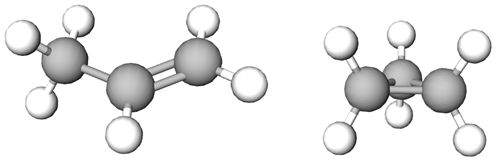
Рис. 1. Пропен і циклопропан – ізомери складу
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Склад і загальна формула алканів.
Завдання скеровано на перевірку вміння застосовувати знання про загальну формулу алканів для визначення алкану за його відносною молекулярною масою.
Загальна формула алканів
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкени.
Завдання скеровано на перевірку вміння розрізняти хімічні властивості й способи добування алкенів.
A етен належить до гомологічного ряду алкенів
Б взаємодією кальцій карбіду з водою добувають етин
B з амоніачним розчином аргентум(І) реагує етин
Г етен окиснюється калій перманганату у водному розчині й знебарвлює його
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкіни. Етин.
Завдання скеровано на перевірку вміння прогнозувати продукти реакції за участі етину.
Продуктом каталітичної гідратації етину є етаналь: відбувається приєднання молекули води за місцем подвійного зв’язку:
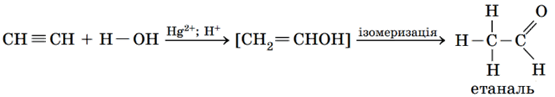
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості органічних речовин.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості органічних речовин для прогнозування можливості перебігу реакцій за їхньої участі.
Молекула бензену містить стійке ароматичне кільце, тому приєднання молекули брому в м’яких умовах неможливе. І на відміну від алкенів й алкінів бензен не знебарвлює бромну воду.
Неподілена електронна пара атома Нітрогену взаємодіє з ароматичною системою зв’язків і частково зміщується від атома Нітрогену до бензенового кільця. Унаслідок цього в бензеновому кільці електронна густина збільшується, найсильніше – у положеннях 2, 4 і 6 відносно аміногрупи. Тому внаслідок добавляння бромної води до аніліну утворюється білий осад 2,4,6‑трибромоаніліну.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості органічних речовин. Якісна реакція на багатоатомні спирти.
Завдання скеровано на перевірку вміння застосовувати знання про якісну реакцію на багатоатомні спирти для розпізнавання їх.
Багатоатомні спирти, до яких належить етан-1,2-діол, реагують зі свіжоосадженим купрум(ІІ) гідроксидом з утворенням яскраво-синього розчину.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Класифікація карбонових кислот.
Завдання скеровано на перевірку вміння класифікувати карбонові кислоти за основністю і складом вуглеводневого ланцюга.
Умову завдання задовольняє кислота, структурна формула якої
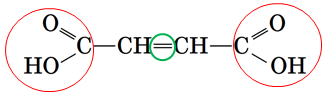
У молекулі цієї кислоти є подвійний зв’язок і дві карбоксильні групи, тобто вона ненасичена двоосновна.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Жири.
Завдання скеровано на перевірку знання способів добування і застосування жирів.
I. Жири – естери вищих карбонових кислот і триатомного спирту гліцеролу.
II. Гідруванням рідких ненасичених жирів добувають тверді насичені – маргарин.
У молекулах рідких жирів на відміну від твердих є подвійні карбон-карбонові зв’язки. За місцем подвійного зв’язку можлива реакція приєднання, у результаті чого ненасичена сполука перетворюється на насичену, зокрема рідкий жир – на твердий:
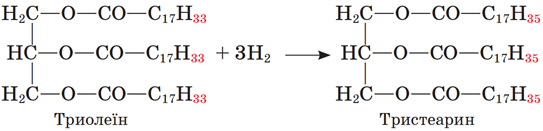
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Характеристичні (функціональні групи). Глюкоза.
Завдання скеровано на перевірку знання складу й будов молекули глюкози й уміння розпізнавати характеристичні групи в її молекулі.
Характеристична група – це атом або група атомів, що визначає природу речовини, тобто її належність до певного класу органічних сполук, і зумовлює її найхарактерніші хімічні властивості.
Глюкоза – альдегідоспирт, у її молекулі є альдегідна
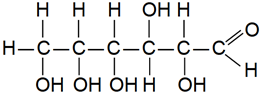
Рис. 1. Структурна формула глюкози
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Аміни.
Завдання скеровано на перевірку знання властивостей амінів.
Первинним є атом Нітрогену, сполучений з атомом Карбону одним простим зв’язком, вторинним – з’єднаний із двома атомами Карбону двома простими зв’язками, третинним – сполучений із трьома атомами Карбону трьома простими зв’язками.
Залежно від цього розрізняють аміни первинної, вторинної, третинної будови.
A диметиламін належить до вторинних амінів
Б диметиламін не реагує із солями в розчині
B диметиламін не використовують для виробництва капрону
Г диметиламін є сильнішою за анілін основою
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку знання хімічних властивостей спиртів й способів добування альдегідів.
Спирти можна окиснити до альдегідів:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Склад і будова атомів хімічних елементів. Електронні формули атомів і простих йонів.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів і простих йонів.
| Частинка | Протонне число | Кількість електронів в атомі |
Електронна формула | ||
| 1 | Атом |
19 | 19 | A | |
| 2 | Атом |
9 | 9 | Д | |
| 3 | Йон |
12 | 10 | Г | |
| 4 | Йон |
16 | 18 | Б |
Відповідь: 1А, 2Д, 3Г, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Класифікація неорганічних речовин.
Завдання скеровано на перевірку вміння класифікувати неорганічні речовини за їхніми хімічними формулами.
| 1 | середня сіль | Г | |
| 2 | кисла сіль | Д | |
| 3 | осно́вний оксид | B | |
| 4 | кислотний оксид | Б |
Відповідь: 1Г, 2Д, 3В, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за кількістю і складом реагентів і продуктів, зміною ступенів окиснення.
| Схема хімічної реакції | Тип хімічної реакції | ||
| 1 | сполучення, окисно-відновна | B | |
| 2 | сполучення, ступені окиснення елементів не змінюються | Б | |
| 3 | розкладання, окисно-відновна | A | |
| 4 | розкладання, ступені окиснення елементів не змінюються | Г |
Відповідь: 1В, 2Б, 3А, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Класи органічних сполук.
Завдання скеровано на перевірку вміння класифікувати органічні речовини за характеристичними групами в їхніх молекулах.
| Назва речовини | Характеристичн(а/і) груп(а/и) в молекулі | Хімічна формула | ||
| 1 | етанова кислота | карбоксильна | Б | |
| 2 | метилетаноат | естерна | A | |
| 3 | метанол | гідроксильна | Д | |
| 4 | етаналь | альдегідна | Г |
Відповідь: 1Б, 2А, 3Д, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Способи добування органічних сполук.
Завдання скеровано на перевірку знання способів добування органічних сполук.
| 1 | фенол добувають гідролізом хлоробензену | Б |
| 2 | глюкозу добувають кислотним гідролізом крохмалю | Д |
| 3 | гліцерол добувають лужним гідролізом жирів | A |
| 4 | ацетилен добувають термічним розкладанням метану | Г |
Відповідь: 1Б, 2Д, 3А, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Хімічні властивості органічних сполук.
Завдання скеровано на перевірку вміння прогнозувати продукти хімічних реакцій за участі органічних речовин.
| 1 | гідруванням пропену добувають насичений вуглеводень пропан | Б |
| 2 | тримеризацією етину добувають ароматичний вуглеводень бензен | A |
| 3 | гідратацією етину добувають альдегід етаналь | Д |
| 4 | гідратацією етену добувають одноатомний насичений спирт етанол | Г |
Відповідь: 1Б, 2А, 3Д, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Відносна густина газів.
Завдання скеровано на перевірку розуміння змісту поняття «відносна густина газу».
Відносна густина першого газу за другим – відношення молярної маси першого газу до молярної маси другого.
Оскільки йдеться про відносну густину газів за тим самим газом, то що більша молярна маса газу, тим більша його відносна густина за гелієм.
| Хімічна формула | Молярна маса (г/моль) | ||
| A | 56 | 4 | |
| Б | 32 | 3 | |
| B | 16 | 1 | |
| Г | 28 | 2 |
Відповідь: 1В, 2Г, 3Б, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Закономірності зміни радіуса атомів і йонів у періодичній системі хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати закономірності зміни радіуса атомів і йонів у періодичній системі хімічних елементів.
Радіус катіона менший за радіус атома того самого хімічного елемента. У періодах радіус атомів зменшується зі збільшенням протонного числа, а в групах – збільшується.
Відповідь: 1А, 2Б, 3В, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масову частку хімічного елемента в речовині за її хімічною формулою.
Дано:
Знайти:
Відповідь: 75.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати середню молярну масу газової суміші.
Дано:
Знайти:
Відповідь: 11.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 20.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння здійснювати обчислення за хімічними рівняннями.
Дано:
1. Знайти:
2. Знайти:
Відповідь: 1. 56. 2. 120.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати масу і молекулярну формулу речовини за її масою і масами продуктів її повного окиснення.
Дано:
1. Знайти:
Для алкену кількістю речовини 1 моль відповідні кількості речовин Карбону й Гідрогену такі:
2. Знайти:
Відповідь: 1. 12. 2. 28.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати масу продукту реакції за відомими масою реагенту й масовою часткою чистої речовини в ньому.
Дано:
Знайти:
Відповідь: 486.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою відновника – 5.
Відповідь: 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 50.
Знайшли помилку? Пишіть на




