ЗНО онлайн 2014 року з хімії – додаткова сесія
Тестові завдання додатвокої сесії ЗНО 2014 року з хімії
ТЕМА: Основні хімічні поняття. Фізичні явища і хімічні реакції.
Завдання скеровано на перевірку вміння розрізняти фізичні явища і хімічні реакції.
Суттєвою ознакою хімічного явища є перетворення речовин.
Під час горіння паперу, іржавіння заліза, бродіння глюкози з одних речовин утворюються інші. Тобто відбуваються хімічні реакції.
Замерзання води – це її перехід із рідкого стану у твердий, під час якого утворення нових речовин не відбувається. Тобто замерзання води – фізичне явище.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Валентність.
Завдання скеровано на перевірку вміння визначати валентність за хімічними формулами.
Ступінь окиснення +4 і валентність IV Сульфур виявляє в сульфітній кислоті, формула якої
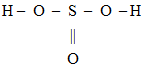
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати природу хімічного елемента за його положенням у періодичній системі.
Лужноземельні елементи належать до ІІ А групи, із-поміж наведених цю умову задовольняє добірка
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу речовини.
Хімічна формула – умовний запис її якісного й кількісного складу за допомогою хімічних символів й індексів.
Молекулярна формула фенолу
У ній записано символи трьох хімічних елементів – Карбону
Праві підрядкові індекси біля хімічних символів у формулі показують кількість атомів відповідного хімічного елемента. Тобто в молекулі фенолу шість атомів Карбону, шість атомів Гідрогену й атом Оксигену – у сумі тринадцять атомів.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Хімічний зв’язок.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й розпізнавати речовини з ковалентним неполярним типом зв’язку.
Ковалентний зв’язок – зв’язок між атомами неметалічних елементів за рахунок спільних електронних пар. Ковалентний зв’язок неполярний, якщо електронегативність атомів хімічних елементів однакова, тобто в неметалах.
У молекулах галогенів, хімічні формули яких
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати місце елемента в періодичній системі.
Карбон – хімічний елемент IV А групи, Титан – IV А групи. Тобто Карбон і Титан – елементи однієї групи, але різних підгруп.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Кристалічні ґратки. Будова речовини.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу й визначати тип кристалічних ґраток у речовині.
Протонні числа хімічних елементів збігаються з їхніми протонними числами. У завданні йдеться про воду (протонне число Гідрогену 1, Оксигену – 8). Кристалічні ґратки у воді молекулярні – у їхніх вузлах містяться її молекули.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Хімічні реакції.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
На рисунку зображено нагрівання кристалогідрату, одним із продуктів розкладання якого є вода, що конденсується і скрапує в посудину.
У реакцію вступає одна складна речовина, утворюються дві складні речовини:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
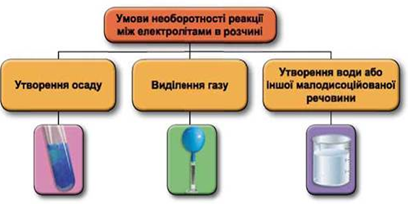
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині не реагують між собою калій хлорид і натрій нітрат:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
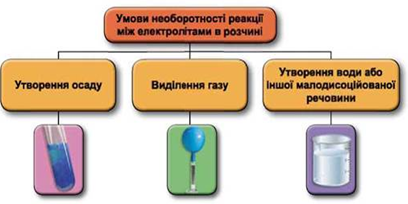
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Скорочене йонне рівняння
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин і складних йонів, визначати кількість відданих або прийнятих під час окисно-відновних реакцій електронів.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині, складати повні й скорочені йонні та йонно-молекулярні рівняння.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
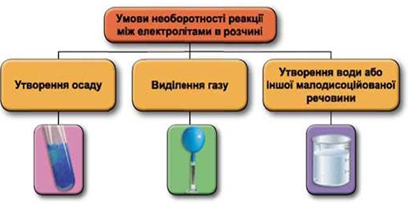
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Взаємодію у водному розчині ферум(ІІ) гідроксиду й хлоридної кислоти описують такими рівняннями:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди й прогнозувати перебіг реакції між оксидами.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
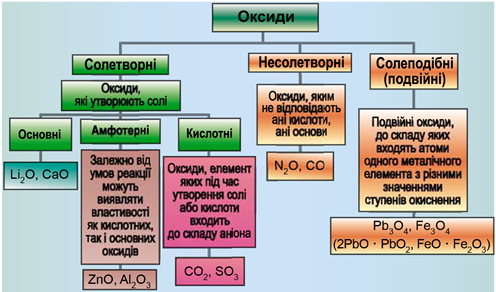
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\(\mathrm{(Mg – Ra)}\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі й води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Із-поміж оксидів, формули яких наведено в умові, лише алюміній оксид не реагує з водою.
Нітроген(V) оксид і сульфур(ІV) оксид є кислотними, реагують із водою з утворенням нітратної та сульфітної кислот відповідно.
Натрій оксид як оксид лужного елемента реагує з водою. Продуктом реакції є луг – натрій гідроксид.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Основи. Способи добування нерозчинних основ.
Завдання скеровано на перевірку знання способів добування нерозчинних основ.
Нерозчинні основи добувають реакцією обміну між сіллю і лугом у водному розчині:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Сульфатна кислота.
Завдання скеровано на перевірку знання особливих властивостей сульфатної кислоти і правил безпечного приготування її розчинів.
Густина сульфатної кислоти більша за густину води. Розчинення сульфатної кислоти – екзотермічний процес, унаслідок чого розчин сильно нагрівається.
Щоб уникнути розбризкування їдкої гарячої рідини, потрібно під час приготування розчину сульфатної кислоти концентровану кислоту тонким струменем уливати у воду за постійного перемішування.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Ортофосфатна кислота.
Завдання скеровано на перевірку вміння прогнозувати склад продуктів реакції нейтралізації ортофосфатної кислоти лугом залежно від мольного відношення реагентів.
Ортофосфатна кислота триосновна.
Якщо натрій гідроксид й ортофосфатну кислоту взято в мольному відношенні 1 : 1, утворюється натрій дигідрогенортофосфат
За мольного відношення лугу й кислоти 2 : 1 утворюється натрій гідрогенортофосфат
За мольного відношення лугу й кислоти 3 : 1 утворюється натрій ортофосфат
Тож внаслідок поступової нейтралізації лугом ортофосфатної кислоти послідовно утворяться солі, формули яких
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Амфотерність.
Завдання скеровано на перевірку розуміння суті амфотерності й уміння розпізнавати амфотерні оксиди.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості. Оксиди й гідроксиди Магнію і Кальцію виявляють осно́вні властивості й реагують із кислотами. Оксид і гідроксид Цинку виявляють амфотерні властивості:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Сполуки Феруму.
Завдання скеровано на перевірку вміння визначати реагенти й прогнозувати продукти реакції за участі сполук Феруму.
У реакції, схему якої наведено в завданні, бере участь ферум(ІІІ) оксид, продуктом реакції є сіль ферум(ІІІ) сульфат і вода.
Речовина
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Лужноземельні метали.
Завдання скеровано на перевірку вміння аналізувати з погляду окиснення-відновлення реакції за участі лужноземельних металів.
Лужноземельні металічні елементи належать до ІІ А групи. У їхніх атомах на зовнішньому енергетичному рівні два електрони. Щоби набути завершеного зовнішнього енергетичного рівня атоми лужноземельних елементів під час хімічних реакцій віддають електрони й, відповідно, окиснюються.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Кальцій оксид і кальцій гідроксид.
Завдання скеровано на перевірку знання хімічних властивостей кальцій оксиду й кальцій гідроксиду, уміння прогнозувати продукти електролітичної дисоціації кальцій гідроксиду.
Головним складником негашеного вапна є кальцій оксид. Унаслідок його реакції з водою утворюється кальцій гідроксид:
У водному розчині кальцій гідроксид дисоціює на катіони Кальцію і гідроксид-аніони:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Алюміній гідроксид.
Завдання скеровано на перевірку розуміння суті явища амфотерності.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості.
Для доведення амфотерності алюміній гідроксиду потрібно використати луг і кислоту:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Залізо.
Завдання скеровано на перевірку вміння прогнозувати продукти хімічних реакцій за участі заліза.
Ферум(ІІІ) хлорид є продуктом реакції заліза з хлором:
Для перетворення ферум(ІІІ) хлориду на ферум(ІІІ) гідроксид потрібно на сіль подіяти лугом у водному розчині:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Будова атома.
Завдання скеровано на перевірку вміння класифікувати хімічні елементи за електронною будовою зовнішнього енергетичного рівня їхніх атомів.
В атомах p-елементів заповнюється електронами зовнішній p-підрівень (рис. 1).
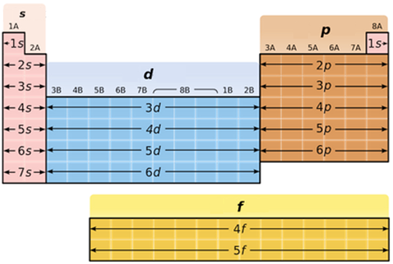
Рис. 1. Положення s-, p-, d-, f-елементів у періодичній системі
До p-елементів належать елементи головних (A) підгруп ІІІ–VIII груп періодичної системи – Флуор, Хлор, Бром, будова зовнішнього енергетичного рівня яких така:
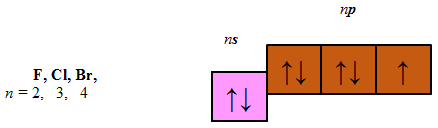
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини. Сірка.
Завдання скеровано на перевірку знання хімічних властивостей сірки.
Сірка згоряє в кисні з утворенням сульфур(ІV) оксиду:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини. Солі амонію. Карбонати.
Завдання скеровано на перевірку знання застосування солей амонію і карбонатів.
Як розпушувач тіста в харчовій промисловості використовують амоній гідрогенкарбонат, який за нагрівання розкладається. Усі продукти його розкладання – гази, які розпушують тісто:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини. Силікати.
Завдання скеровано на перевірку знання галузей застосування силікатів.
Розчинне скло – водний розчин силікатів Натрію і Калію – використовують як силікатний клей.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Будова молекул органічні речовини. π-Зв’язок.
Завдання скеровано на перевірку вміння аналізувати склад і будову молекул органічних сполук.
У молекулах пропану, пропанолу, циклопропану атоми Карбону, Гідрогену й Оксигену сполучені ординарними (простими) σ-зв’язками. В альдегідній групі в молекулі пропаналю атоми Карбону й Оксигену сполучені подвійним зв’язком (рис. 1).
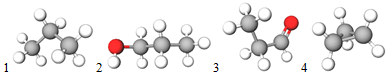
Рис. 1. Моделі молекул пропану (1), пропанолу (2), пропаналю (3), циклопропану (4)
В альдегідній групі атом Карбону утворює три σ-зв’язки, розміщені в одній площині під кутом 120° один до одного. Атоми Карбону й Оксигену перебувають у стані sp2-гібридизації, і σ-зв’язок між ними утворюється за рахунок перекривання гібридизованих електронних хмар. Негібридизовані p-орбіталі атомів Карбону й Оксигену перекриваються з утворенням π-зв’язку (рис. 2).
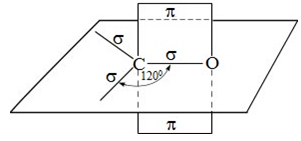
Рис. 2. Утворення σ- і π-зв’язків в альдегідній групі
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Номенклатура алканів.
Завдання скеровано на перевірку вміння називати алкани за систематичною номенклатурою.
Сполуці певної будови відповідає лише одна систематична назва, за якою можна уявити й відтворити будову сполуки, тобто її структурну формулу. Алгоритм побудови назв алканів за систематичною номенклатурою наведено на схемі (рис. 1). Назви алкільних замісників утворюють заміною суфікса -ан у назві алкану на суфікс -ил (-іл). Кількість однакових алкільних замісників позначають множинними префіксами. Два однакові замісники позначають префіксом ди-, три – префіксом три-, чотири – тетра-, п’ять – пента- тощо. Перед приголосними потрібно писати ди-, перед голосними – ді: диметил, але діетил.

Рис. 1. Алгоритм побудови назв алканів за систематичною номенклатурою
В алкані, структурну формулу якого наведено в завданні, шість атомів Карбону в головному ланцюгу, до другого, третього, п’ятого приєднані вуглеводневі замісники (рис. 2).
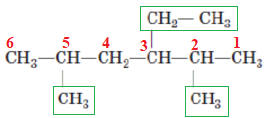
Рис. 2. Структурна формула 3-етил-2,5-диметилгексану
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Ізомерія.
Завдання скеровано на перевірку вміння складати структурні формули ізомерів за молекулярною формулою речовини.
Ізомери – речовини, які мають однаковий якісний і кількісний склад, але різну будову молекул, а тому й різні властивості. Зображення моделей молекул ізомерів складу
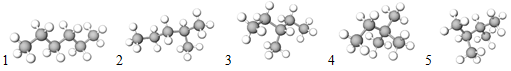
Рис. 1. Ізомери складу
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Гомологи.
Завдання скеровано на перевірку вміння визначати належність вуглеводню до певного гомологічного ряду.
Бут-1-ен належить до гомологічного ряду алкенів. Загальна формула вуглеводнів цього ряду –
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Етин. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку знання способів добування етину.
Етин є продуктом реакції між кальцій карбідом і водою:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Вуглеводні. Бензен.
Завдання скеровано на перевірку знання хімічних властивостей вуглеводнів.
Пропен, етин і пропін є ненасиченими вуглеводнями, вони легко окиснюються калій перманганатом у водному розчині. Бензен стійкий до дії окисників, тому з калій перманганатом у водному розчині не реагує.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Застосування метану.
Завдання скеровано на перевірку знання галузей застосування вуглеводнів.
Усі речовини, зазначені в умові завдання, здатні горіти. Проте в побуті як пальне масово використовують метан.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Спирти. Етанол.
Завдання скеровано на перевірку знання хімічних властивостей етанолу.
Продуктом внутрішньомолекулярної дегідратації етанолу є етен:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Спирти. Етанол.
Завдання скеровано на перевірку знання хімічних властивостей етанолу.
Продуктом окиснення етанолу є етаналь:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Естери. Жири.
Завдання скеровано на перевірку знання хімічної природи жирів.
Жири – естери триатомного спирту гліцеролу й вищих карбонових кислот.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Вуглеводи.
Завдання скеровано на перевірку знання властивостей целюлози.
Целюлоза – полісахарид, тверда волокниста речовина, нерозчинна у воді й органічних розчинниках, не взаємодіє з водно-спиртовим розчином йоду.
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Амінокислоти.
Завдання скеровано на перевірку знання хімічних властивостей амінокислот.
Амінокислоти містять дві характеристичні групи – аміно- й карбоксильну. Тому амінокислоти виявляють амфотерні властивості й реагують і з лугами, і з кислотами.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Високомолекулярні органічні сполуки.
Завдання скеровано на перевірку вміння прогнозувати склад продукту полімеризації за хімічною формулою мономера.
Мономер – низькомолекулярна речовина, продуктом полімеризації якої є високомолекулярна речовина – полімер.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Генетичні зв’язки між класами органічних речовин.
Завдання скеровано на перевірку вміння визначати реагенти й прогнозувати продукти реакцій за участі органічних речовин.
Речовина
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння розпізнавати хімічні реакції різних типів.
У реакцію (1) вступають дві складні речовини, утворюється одна складна речовина. Це реакція сполучення (Г).
У реакцію (2) вступають дві складні речовини, утворюються дві складні речовини. Це реакція обміну (В).
У реакцію (3) вступає одна складна речовина, утворюються одна складна й одна проста речовини. Це реакція розкладання (Д).
У реакцію (4) вступають проста й складна речовини, утворюються проста й складна речовини. Це реакція заміщення (А).
Відповідь: 1Г, 2В, 3Д, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння розпізнавати типи хімічних реакцій за участі органічних речовин.
1 Від молекули етану відщеплюється молекула водню, це реакція дегідрування (Д)
2 Від молекули етанолу відщеплюється молекула води, це реакція дегідратації (А)
3 З мономеру 1,1,2,2-тетрафлуороетену утворюється полімер – політетрафлуороетан або тефлон (Г)
4 Етилетаноат вступає в реакцію обміну з водою, це реакція гідролізу (В)
Відповідь: 1Д, 2А, 3Г, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку знання тривіальних назв неорганічних речовин.
1 натрій гідрогенкарбонат – питна сода (Б)
2 силіцій(IV) оксид – кварцовий пісок (Д)
3 натрій хлорид – кам’яна сіль (А)
4 кальцій гідроксид – гашене вапно (Г)
Відповідь: 1Б, 2Д, 3А, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні речовини різних класів.
Речовина (1) утворена катіонами Кальцію і карбонат-аніонами – кальцій карбонат, сіль (Г).
Речовина (2) містить атоми Гідрогену й кислотний залишок силікат – силікатна кислота (В).
Речовина (3) утворена катіонами Алюмінію і гідроксид-аніонами – амфотерний алюміній гідроксид (Д).
Речовина (4) – сульфур(IV) оксид, бінарна сполука Сульфуру й Оксигену, у молекулах якої ступінь окиснення атомів Оксигену становить –2 (А).
Відповідь: 1Г, 2В, 3Д, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура органічних сполук.
Завдання скеровано на перевірку вміння називати органічні речовини за систематичною номенклатурою.
Молекула речовини 1 містить карбоксильну характеристичну групу, у її молекулі один атом Карбону, це метанова кислота (Д).
У молекулі речовини 2 вуглеводневий замісник метил сполучений із характеристичною гідроксильною групою, це етанол (А).
У молекулі речовини 3 є аміно- і карбоксильна характеристичні групи, три атоми Карбону в головному ланцюгу, це амінопропанова кислота (Г).
Молекула речовини 4 містить альдегідну характеристичну групу, у її молекулі два атоми Карбону, це етаналь (В).
Відповідь: 1Д, 2А, 3Г, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура органічних сполук.
Завдання скеровано на перевірку розуміння зумовленості застосування органічних речовин їхніми властивостями.
Із хлоробензену (1) добувають фенол (Б):
З етену (2) добувають поліетилен (Д):
Глюкоза (3) солодка на смак, тому її використовують як підсолоджувач харчових продуктів (A):
Целюлоза (4) – полімерна волокниста речовина, із неї виготовляють папір (Г):
Відповідь: 1Б, 2Д, 3А, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Обчислення в хімії. Відносна густина газів.
Завдання скеровано на перевірку розуміння фізичного змісту відносної густини газів й уміння застосовувати наслідки із закону Авогадро.
Відносна густина
Відповідь: 1Г, 2А, 3В, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Обчислення в хімії. Відносна густина газів.
Завдання скеровано на перевірку знання способу добування аніліну.
Послідовність добування аніліну така:
Відповідь: 1В, 2Г, 3Б, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Відносна молекулярна маса.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу речовини за її хімічною формулою.
Дано:
Знайти:
Відповідь: 75.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Відносна густина газів.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу речовини за її відносною густиною.
Дано:
Знайти:
Відповідь: 58.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Кристалогідрати.
Завдання скеровано на перевірку вміння визначати хімічний склад кристалогідрату.
Дано:
Знайти:
Відповідь: 36.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Молярний об’єм газів.
Завдання скеровано на перевірку вміння обчислювати кількість речовини газу за його об’ємом.
Дано:
Знайти:
Відповідь: 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами.
Завдання скеровано на перевірку вміння прогнозувати склад молекул за відомою кількістю нуклідів, із яких вони утворені.
Відповідь: 6.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами.
Завдання скеровано на перевірку вміння обчислювати масу хімічного елемента в речовині за її масою.
Дано:
Знайти:
Відповідь: 14.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Комбіновані задачі.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 40.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розчини. Масова частка розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку складника розчину за його кількістю речовини й масою води.
Дано:
Знайти:
Відповідь: 20.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення об’єму продукту реакції між газуватими речовинами, якщо одну з них узято в надлишку.
Завдання скеровано на перевірку вміння розв’язувати задачі з обчислення об’єму продукту реакції між газуватими речовинами, якщо одну з них узято в надлишку.
Дано:
Знайти:
Кисень у надлишку – із метаном об'ємом 8 л прореагує кисень об'ємом 16 л, а для реакції взято кисень об'ємом 20 л.
Відповідь: 8.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Комбіновані задачі.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 29
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою відновника –
Відповідь: 3.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Виведення молекулярної формули речовини за об’ємом газуватого продукту реакції за її участі.
Завдання скеровано на перевірку вміння виводити молекулярну формулу речовини за об’ємом газуватого продукту реакції за її участі.
Дано:
Знайти:
Відповідь: 6.
Знайшли помилку? Пишіть на




