ЗНО онлайн 2015 року з хімії – пробний тест
Тестові завдання пробного тесту ЗНО 2015 року з хімії
ТЕМА: Основні хімічні поняття. Хімічні формули.
Завдання скеровано на перевірку вміння інтерпретувати хімічні формули речовин.
У хімічній формулі кількість хімічних елементів визначають за кількістю їхніх символів.
| Формула речовини | Кількість хімічних елементів (видів атомів), якими утворена речовина |
| 1 ( |
|
| 2 ( |
|
| 3 ( |
|
| 2 ( |
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати групу й підгрупу хімічного елемента в періодичній системі.
З-поміж поданих варіантів умову завдання задовольняє добірка з трьох елементів: Силіцій, Германій, Плюмбум належать до IV А підгрупи.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати формули леткої сполуки хімічного елемента з Гідрогеном, вищого оксиду і його гідрату за положенням елемента в періодичній системі.
Формула вищого оксиду хімічного елемента, який утворює летку сполуку з Гідрогеном складу
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів.
Завдання скеровано на перевірку вміння інтерпретувати нуклідні символи атомів і простих йонів.
Нуклід – це різновид атомів або йонів з однаковим масовим числом (кількість нуклонів) та атомним номером (кількістю протонів).
Нуклідним символом називають символ нукліда елемента, біля якого зазначено атомний номер як лівий підрядковий, а масове число – як лівий надрядковий індекс.
Нуклони – це протони й нейтрони. Кількість нейтронів у ядрі дорівнює різниці між масовим і протонним числами.
Умову завдання задовольняє варіант відповіді Б: у нукліді
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів. Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів, визначати формулу гідрату оксиду хімічного елемента за місцем елемента в періодичній системі.
Оскільки в атомі хімічного елемента на зовнішньому енергетичному рівні три електрони, можна дійти висновку, що це елемент ІІІ А підгрупи. Тобто хімічна формула його гідроксиду
Відносна атомна маса 27 в Алюмінію, його протонне число 13.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів. Періодична система хімічних елементів. Хімічний зв’язок.
Завдання скеровано на перевірку вміння аналізувати будову атомів хімічних елементів, визначати тип хімічного зв’язку в речовині за її формулою.
Протонні числа атомів хімічних елементів збігаються з їхніми номерами в періодичній системі, тобто йдеться про бінарну сполуку Калію з Бромом – калій бромід, формула якого
Калій – типовий металічний, а Бром – типовий неметалічний елемент. Атом Калію легко втрачає електрон зовнішнього енергетичного рівня й перетворюється на однозарядний катіон. Атом Брому легко приймає електрон для завершення зовнішнього енергетичного рівня і перетворюється на однозарядний аніон. Хімічний зв'язок між катіоном й аніоном – йонний.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Типи кристалічних ґраток.
Завдання скеровано на перевірку вміння прогнозувати тип хімічного зв’язку в речовині за її властивостями.
Описані властивості – низькі температури кипіння і плавлення властиві речовинам iз молекулярними кристалічними ґратками. Сили притягання між молекулами у вузлах кристалічних ґраток слабкі, тому речовина має порівняно низькі температури плавлення і кипіння.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і визначати окисники й відновники.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю.
Окиснення – утрачання електронів атомом або йоном, відновлення – процес, протилежний окисненню.
Окисники приєднують електрони, відновники – віддають.
У цій реакції манган(IV) оксид є відновником, а в зміні ступеня окиснення Хлору беруть участь шість електронів.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
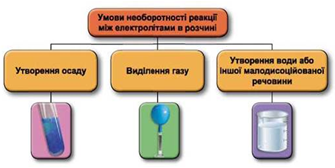
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині не реагують між собою натрій нітрат і кальцій гідроксид, оскільки поміж йонів, які утворюються внаслідок їхньої електролітичної дисоціації, немає таких, що взаємодіють з утворенням слабкого електроліту.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині й складати повні й скорочені йонно-молекулярні рівняння.
Цинк оксид – нерозчинна у воді речовина, вода не практично не дисоціює. Гідроген хлорид – сильний електроліт, який у водному розчині дисоціює на катіони Гідрогену й хлорид-аніони. На катіони Цинку й хлорид-аніони дисоціює цинк хлорид – розчинна у воді сіль:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати осно́вні, кислотні, амфотерні оксиди й прогнозувати можливість перебігу хімічних реакцій за їхньої участі.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
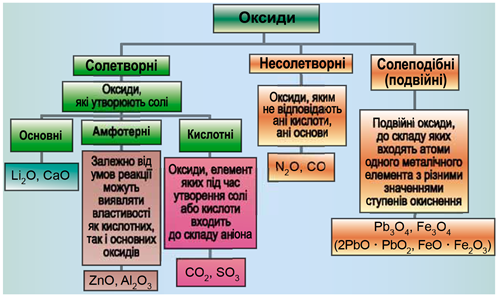
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\(\mathrm{(Mg – Ra)}\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
З-поміж поданих пар оксидів реакція відбувається між осно́вним кальцій оксидом і кислотним фосфор(V) оксидом:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку знання властивостей лугів.
Натрій гідроксид – луг (розчинна основа). Це – електроліт, який у водному розчині дисоціює на катіони Натрію і гідроксид-аніони:
Під дією гідроксид-аніонів у водному розчині фенолфталеїн набуває малинового кольору.
Натрій гідроксид реагує з кислотними оксидами.
Натрій гідроксид – речовина йонної будови.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електролітична дисоціація кислот. Сильні й слабкі електроліти.
Завдання скеровано на перевірку вміння складати й інтерпретувати рівняння електролітичної дисоціації кислот.
Кислоти – електроліти, які під час дисоціації у водному розчині не утворюють інших катіонів окрім катіонів Гідрогену. Рівняння електролітичної дисоціації кислот, про які йдеться в завданні, такі:
Сульфатна й нітратна кислоти – сильні електроліти, тож у розведених водних розчинах дисоціюють повністю.
Кількість речовини катіонів Гідрогену вдвічі більша за кількість речовини сульфатної кислоти і становить, відповідно, 0,001 моль.
Кількість речовини катіонів Гідрогену така сама, як кількість речовини нітратної кислоти і становить, відповідно, 0,001 моль.
Етанова кислота – дуже слабкий електроліт, тому кількість речовини катіонів Гідрогену значно менша за кількість речовини етанової кислоти, тобто за 0,001 моль.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку вміння розпізнавати середні солі за їхніми хімічними формулами.
Солі – йонні сполуки, утворені катіонами металічних елементів або амонію й аніонами кислотних залишків. Кислі солі – продукти неповного заміщення атомів Гідрогену в молекулі кислоти на катіони амонію або металічних елементів.
Середньою сіллю є калій перманганат (A).
Амоній гідрогенсульфат (Б) і калій дигідрогенфосфат (Г) – кислі солі, магній гідроксихлорид (В) – осно́вна сіль.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Явище амфотерності.
Завдання скеровано на перевірку розуміння суті амфотерності, уміння аналізувати й прогнозувати результати дослідження, робити висновки.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або основні, або кислотні властивості. Наприклад, із кислотами цинк оксид реагує як основний, із лугами – як кислотний:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку вміння використовувати закон збереження маси речовин і розпізнавати неорганічні сполуки за їхніми властивостями.
У завданні наведено схему реакції обміну між лугом і невідомою речовиною. Продукти цієї реакції – нерозчинна сіль і натрій гідроксид. За законом збереження маси речовин під час хімічних реакцій можна дійти висновку, що невідома речовина – натрій карбонат:
Натрій карбонат утворений катіонами металічного елемента й аніоном кислотного залишку, це – середня сіль.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Будова атома. Класифікація хімічних елементів.
Завдання скеровано на перевірку вміння визначати будову атомів хімічних елементів за їхнім місцем у періодичній системі.
Хімічні елементи класифікують на
Берилій, Кальцій, Магній – елементи 2 А групи періодичної системи хімічних елементів. В їхніх атомах на зовнішньому енергетичному рівні перебувають два
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійна твердість води зумовлена катіонами
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку вміння прогнозувати результати перебігу реакцій між металом і сіллю в її водному розчині.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що алюміній як активніший метал витіснятиме із солі мідь (рис. 1).

Рис. 1. Ряд активності металів
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза та сполук Феруму(ІІ) і Феруму(ІІІ).
A
Б
B
Г
Ферум є відновником у реакції ферум(ІІ) хлориду з хлором.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Якісні реакції на деякі йони.
Завдання скеровано на перевірку знання якісних реакцій на деякі йони й розуміння умов необоротності перебігу реакцій між електролітами в розчині.
Реактивом на хлорид-аніони є катіони Аргентуму(І), за їхньою допомогою можна розрізнити водні розчини натрій хлориду й натрій нітрату:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодична система хімічних елементів.
Завдання скеровано на перевірку вміння визначати формули характерних для хімічного елемента сполук за його місцем у періодичній системі.
У завданні наведено формули двох кислих солей. Це солі, утворені двохосновними кислотами того самого хімічного елемента. Їхні хімічні формули
Це свідчить, що елемент
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Сполуки Нітрогену.
Завдання скеровано на перевірку знання властивостей сполук Нітрогену й уміння застосовувати закон збереження маси для складання хімічних рівнянь.
Схемі перетворень, наведеній у завданні, відповідають такі хімічні рівняння:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Карбонати й гідрогенкарбонати.
Завдання скеровано на перевірку знання властивостей солей карбонатної кислоти, взаємного перетворення карбонатів і гідрогенкарбонатів.
Натрій гідрогенкарбонат – кисла сіль, тому реагує з натрій гідроксидом:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Систематична номенклатура органічних сполук.
Завдання скеровано на перевірку вміння розпізнавати органічні сполуки різних класів і називати їх за систематичною номенклатурою.
У завданні наведено структурну формулу галогенопохідної насиченого одноатомного спирту. Називати спирти за систематичною номенклатурою потрібно за алгоритмом, наведеним на схемі (рис. 1).
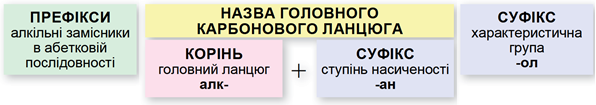
Рис. 1. Алгоритм побудови назв спиртів за систематичною номенклатурою
Важливо пам’ятати:
- потрібно нумерувати карбоновий ланцюг із того кінця, до якого ближче розташована гідроксильна група;
- якщо гідроксильна група рівновіддалена від обох кінців головного карбонового ланцюга, то його нумерують із того кінця, до якого ближче розташований алкільний замісник;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, то його нумерують так, щоби замісник, назву якого за абеткою вживають раніше, був позначений найменшим числом;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, але з одного кінця замісників більше, то нумерацію проводять з урахуванням положення замісників, позначених найменшими числами.
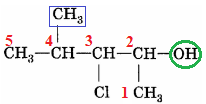
Назва спирту – 4-метил-3-хлоропентан-2-ол.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Типи хімічних реакцій в органічній хімії. Хімічні властивості алканів.
Завдання скеровано на перевірку знання хімічних властивостей алканів і вміння класифікувати хімічні реакції за їхньої участі.
Бутан – насичений вуглеводень, вступає в реакції повного окиснення (2), заміщення (3), ізомеризації (5).
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Типи хімічних реакцій в органічній хімії. Способи добування алкенів.
Завдання скеровано на перевірку знання способів добування алкенів і вміння класифікувати хімічні реакції за участі оксигеновмісних органічних сполук.
Етен є продуктом внутрішньомолекулярної дегідратації етанолу:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Якісні реакції на органічні сполуки.
Завдання скеровано на перевірку вміння застосовувати знання про якісні реакції на органічні сполуки для їхнього розпізнавання.
Етин від етену можна відрізнити за допомогою амоніачного розчину аргентум(І) оксиду. Зв’язок
Такі сполуки виявляють слабкі кислотні властивості й здатні вступати в реакції заміщення, зокрема заміщувати атом Гідрогену на атом металічного елемента, наприклад:
Етен з аргентум(І) оксидом не реагує.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні.
Завдання скеровано на перевірку вміння розпізнавати ароматичні вуглеводні за загальною формулою вуглеводнів гомологічного ряду аренів.
Загальна формула аренів –
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Природні джерела вуглеводнів.
Завдання скеровано на перевірку знання продуктів переробки вуглеводневої сировини.
Синтетичне рідке паливо – горючі рідини, синтезовані із суміші газів (
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні класи органічних сполук. Характеристичні групи. Фенол.
Завдання скеровано на перевірку знання характеристичних груп органічних сполук.
Характеристична група – це атом або група атомів, що визначає природу речовини, тобто її належність до певного класу органічних сполук, і зумовлює її найхарактерніші хімічні властивості. Гідроксильна група – характеристична група фенолів.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між основними класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами органічних сполук.
Продуктом окиснення етанолу є етаналь. Унаслідок часткового окиснення етаналю купрум(ІІ) гідроксидом утворюється етанова кислота, формула якої
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Естери. Жири.
Завдання скеровано на перевірку знання хімічного складу й властивостей естерів і жирів.
Жири – естери триатомного спирту гліцеролу й вищих карбонових кислот. Саме ці речовини утворюються внаслідок кислотного гідролізу жирів.
Олії містять залишки ненасичених карбонових кислот. Унаслідок гідрування олій ці залишки стають насиченими, а жир – твердим. У такий спосіб у промисловості добувають маргарин.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи.
Завдання скеровано на перевірку знання продуктів часткового гідролізу крохмалю.
Продуктом часткового гідролізу крохмалю є декстрин.
Щодо інших варіантів відповіді: глюкоза – продукт повного гідролізу крохмалю, глікоген має тваринне походження, це основний запасний вуглевод організму людини і тварин, одним із продуктів гідролізу крохмалю є не сахароза, а її ізомер мальтоза.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами органічних сполук.
Унаслідок термічного розкладання метану утворюється етин (1). Продуктом тримеризації етину є бензен (2). Нітруванням бензену добувають нітробензен (
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Високомолекулярні органічні сполуки.
Завдання скеровано на перевірку знання складу найпоширеніших полімерів.
У завданні наведено формулу продукту полімеризації пропену – поліпропілен.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
1
2
3
4 у реакцію розкладання вступає одна складна речовина, утворюються дві речовини, не змінюються ступені окиснення хімічних елементів – A.
Відповідь: 1В, 2Д, 3Г, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних речовин.
Завдання скеровано на перевірку вміння класифікувати неорганічні речовини за їхніми формулами.
1 бінарна сполука металічного елемента з неметалічним – середня сіль – Г.
2 продукт неповного заміщення атомів Гідрогену в молекулі карбонатної кислоти на атоми Натрію – кисла сіль – Д.
3 розчинна складна речовина утворена катіонами Калію і гідроксид-аніонами – В.
4 бінарна сполука металічного елемента з киснем, у якій ступінь окиснення Оксигену –2 – A.
Відповідь: 1Г, 2Д, 3В, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних речовин.
Завдання скеровано на перевірку знання складу мінералів і їхніх назв.
1
2
3
4
Відповідь: 1Г, 2В, 3Д, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Класифікація реакцій в органічній хімії.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за участі органічних сполук.
1 гідроліз крохмалю або целюлози – Д.
2 гідрування олеїнової кислоти – Г.
3 дегідратація етанолу – В.
4 часткове окиснення етанолу – Б.
Відповідь: 1Д, 2Г, 3В, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Класи органічних сполук.
Завдання скеровано на перевірку вміння класифікувати органічні речовини за їхніми формулами.
1 метилетаноат – естер – Б.
2 сахароза – вуглевод – В.
3 пропан – вуглеводень – Д.
4 диметиламін – амін – Г.
Відповідь: 1Б, 2В, 3Д, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості органічних сполук.
Завдання скеровано на перевірку вміння прогнозувати продукти хімічних реакцій за участі органічних сполук.
1 продуктами термічного розкладання метану є етин і водень – Г.
2 продуктами повного окиснення пропану є карбон(IV) оксид і вода – Б.
3 продуктом гідрування бензену є циклогексан – В.
4 продуктом часткового окиснення етанолу є етаналь – А.
Відповідь: 1Г, 2Б, 3В, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Атоми і прості йони. Радіус атома.
Завдання скеровано на перевірку вміння порівнювати радіуси атомів і простих йонів.
Радіуси атомів більші за радіуси відповідних простих катіонів. Зі зростанням протонного числа в головних підгрупах радіуси атомів збільшуються, а в періодах – зменшуються.
Радіус атома Рубідію більший за радіус атома Калію. Радіус атома Кальцію менший за радіус атома Калію, а радіус катіона Кальцію менший за радіус його атома.
Радіус частинок зменшується від атома Рубідію до катіона Кальцію в ряду
Відповідь: 1Б, 2А, 3В, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Електронегативність.
Завдання скеровано на перевірку вміння порівнювати електронегативність хімічних елементів за їхнім місцем у періодичній системі.
Зі зростанням протонного числа в головних підгрупах електронегативність атомів зменшується, а в періодах – збільшується. Електронегативність Оксигену найбільша порівняно з іншими хімічними елементами, про які йдеться в завданні. Електронегативність Хлору більша за електронегативність Фосфору (обидва – хімічні елементи третього періоду). Електронегативність Селену більша за електронегативність Фосфору.
Електронегативність збільшується від Фосфору до Оксигену в ряду елементів
Відповідь: 1Г, 2А, 3Б, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну густину газу.
Дано:
Знайти:
Відповідь: 4.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу хімічного елемента в речовині за її кількістю.
Дано:
Знайти:
Відповідь: 18.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу хімічного елемента в речовині за її кількістю.
Дано:
Знайти:
Відповідь: 85.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
1. Знайти:
2. Знайти:
Відповідь: 1. 75. 2. 8.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
1. Знайти:
2. Знайти:
Відповідь: 1. 224. 2. 80.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу продукту реакції за об’ємом одного з газуватих реагентів.
Дано:
Знайти:
Відповідь: 64.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 8.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою окисника –
Відповідь: 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 208.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Знайти:
Відповідь: 30.
Знайшли помилку? Пишіть на




