ЗНО онлайн 2013 року з хімії – додаткова сесія
Тестові завдання додаткової сесії ЗНО 2013 року з хімії
ТЕМА: Основні хімічні поняття. Хімічний елемент. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою.
Хімічна формула – запис, що показує якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
За наведеною в умові завдання формулою можна визначити кількість видів атомів (хімічних елементів) у кожній речовині:
А один хімічний елемент (
Б два хімічні елементи (
В три хімічні елементи (
Г два хімічні елементи (
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Хімічна формула. Молярна маса. Кількісні відношення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини за її хімічною формулою.
Молярна маса – маса речовини кількістю 1 моль чисельно дорівнює відносній молекулярній масі, яку обчислюють як суму добутків відносних атомних мас хімічних елементів і правих підрядкових індексів біля їхніх хімічних символів у формулі.
Для натрій гідрогенкарбонату
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Періодичний закон і періодична система хімічних елементів. Металічні й неметалічні елементи. Будова атома.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
У періодах зі збільшенням атомних мас металічний характер елементів послаблюється, а неметалічний – посилюється.
А
Б
В
Г
Нітроген
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Періодичний закон і періодична система хімічних елементів. Будова атома. Електронні формули атомів, йонів.
Завдання скеровано на перевірку вміння визначати кількість електронів в атомі, йоні.
Порядковий номер Сульфуру в періодичній системі хімічних елементів
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Хімічний зв’язок.
Завдання скеровано на перевірку вміння аналізувати хімічні формули й розпізнавати речовини з ковалентним неполярним типом зв’язку.
Ковалентний зв’язок – зв’язок між атомами неметалічних елементів за рахунок спільних електронних пар. Ковалентний зв’язок неполярний, якщо електронегативність атомів хімічних елементів однакова, тобто в неметалах.
У молекулі кисню, хімічна формула якого
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Періодичний закон і періодична система хімічних елементів. Будова атома.
Завдання скеровано на перевірку вміння визначати протонне число хімічного елемента за його місцем у періодичній системі.
У четвертому періоді VІ групі побічній підгрупі міститься Хром. Його порядковий номер 24, тож і протонне число цього хімічного елемент – 24.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Швидкість хімічної реакції.
Завдання скеровано на перевірку розуміння впливу різних чинників на швидкість хімічної реакції.
Швидкість хімічної реакції – це швидкість утворення її продуктів або витрачання реагентів.
Швидкість хімічної реакції можна зменшити, якщо використати інгібітор. Він змінює механізм реакції, уповільнює її перебіг.
Температура, за якої відбувається хімічна реакція, також позначається на її швидкості. Зі зростанням температури хімічні реакції переважно пришвидшуються. Це зумовлено збільшенням умісту активних молекул (чи інших структурних частинок) у реакційній суміші. Натомість охолодження уповільнює взаємодію між реагентами. Саме тому харчові продукти зберігають за низьких температур.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Групи хімічних елементів.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій за участі галогенів і їхніх сполук.
Хлор як активніший галоген витісняє менш активні галогени
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Добування амоніаку.
Завдання скеровано на перевірку знання способів добування неорганічних речовин, тривіальних назв деяких із них.
Нашатир – тривіальна назва амоній хлориду
Амоніак
Густина амоніаку менша за густину повітря, тому його збирають витісненням останнього з пробірки, розташованої догори дном.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Суміші.
Завдання скеровано на перевірку вміння класифікувати суміші, розпізнавати емульсії.
Емульсії – дисперсні системи, які утворені рідинами, що не змішуються. Тобто емульсії належать до неоднорідних сумішей.
У молоці краплі молочного жиру розподілені у водному середовищі. Тож молоко є емульсією. Про це свідчить і розшарування молока: із часом крапельки жиру спливають угору й утворюють на поверхні молока суцільний шар.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди й прогнозувати перебіг реакції між оксидами й водою.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
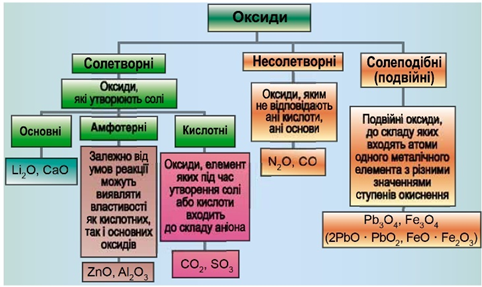
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\(\mathrm{(Mg – Ra)}\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі й води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Із-поміж оксидів, формули яких наведено в умові, лише літій оксид реагує з водою з утворенням лугу – літій гідроксиду:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди й прогнозувати перебіг реакції між оксидами й водою.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
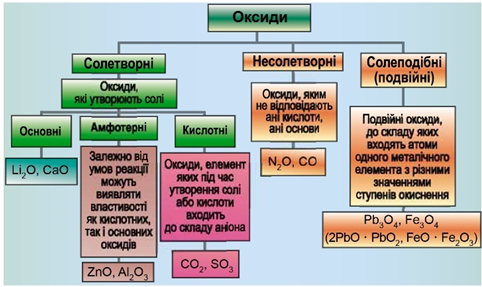
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\(\mathrm{(Mg – Ra)}\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі й води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Кальцій оксид реагує з водою з утворенням лугу – кальцій гідроксиду:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди й прогнозувати перебіг реакції між оксидами й водою.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
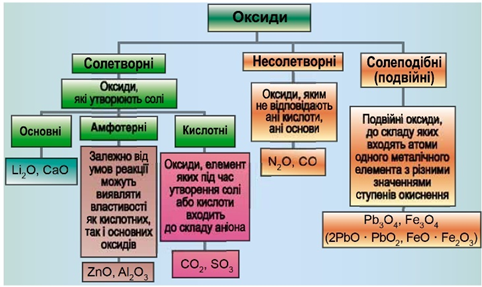
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію
\(\mathrm{(Mg – Ra)}\) ; - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі й води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Із-поміж оксидів, формули яких наведено в умові, лише сульфур(ІV) оксид є кислотними, реагує з водою з утворенням сульфітної кислоти:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води та способів пом’якшення води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Тимчасову (карбонатну) твердість води зумовлено катіонами
З-поміж речовин, формули яких наведено в завданні, для пом’якшення води використовують кальцій гідроксид, що забезпечує осадження з розчину катіонів Кальцію і гідрогенкарбонат-аніонів:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Амфотерність. Алюміній гідроксид.
Завдання скеровано на перевірку розуміння суті амфотерності.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості. З кислотами алюміній гідроксид
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
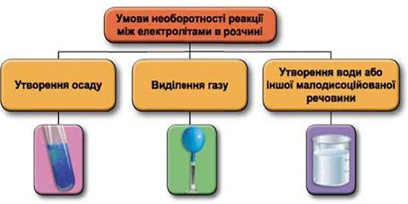
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині реагують купрум(ІІ) сульфат і барій хлорид, унаслідок цього утворюється осад барій сульфату:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку знання хімічних властивостей металів; розуміння, за яких умов метал реагує із сіллю.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що з-поміж наведених пар «метал – сіль» лише залізо реагуватиме з купрум(ІІ) сульфатом у водному розчині, оскільки в ряду активності воно розташоване лівіше від міді:
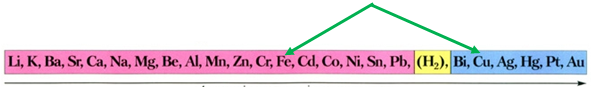
Рис. 1. Ряд активності металів
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Хімічні властивості солей.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакції солі з кислотою.
Сильні й нелеткі кислоти витісняють із солей слабкі, леткі, нестійкі кислоти (рис. 1).
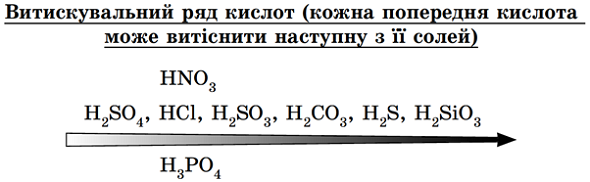
Рис. 1. Витискувальний ряд кислот
Із сильною хлоридною кислотою реагує сіль слабшої карбонатної кислоти – кальцій карбонат
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини. Алюміній.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію. Під дією концентрованих сульфатної та нітратної кислот на поверхні алюмінію утворюється стійка плівка алюміній оксиду.
З-поміж наведених варіантів умову завдання задовольняє варіант, у якому наведено формулу сульфатної кислоти й зазначено, що вона концентрована.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену, Оксигену й Флуору у складних речовинах зазвичай становлять +1, –2 і –1 відповідно.
Різні ступені окиснення Ферум виявляє у речовині, формула якої
А
Б
В
Г
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Природні родини хімічних елементів. Галогени.
Завдання скеровано на перевірку знання структури періодичної системи хімічних елементів.
Галогени – елементи VIIА (17) групи періодичної системи хімічних елементів – Флуор, Хлор, Бром, Йод, Астат. Хімічні символами галогенів утворено рядок Б:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Солі.
Завдання скеровано на перевірку вміння розпізнавати формули кислих солей сульфатної кислоти.
Кисла сіль – продукт неповного заміщення атомів Гідрогену в молекулі кислоти атомами металічного елемента.
Умову завдання задовольняє речовина, формула якої
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Солі. Неорганічна хімія. Солі амонію.
Завдання скеровано на перевірку вміння розпізнавати формули солей амонію.
Катіон амонію утворюється внаслідок приєднання катіона Гідрогену до молекули амоніаку:
Умову завдання задовольняє формула амоній сульфату
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічнх сполук. Генетичні зв’язки між ними.
Завдання скеровано на перевірку знання способів добування оксидів і вміння встановлювати генетичні зв’язки між класами неорганічних сполук.
Сильні й нелеткі кислоти витісняють із солей слабкі, леткі, нестійкі кислоти (рис. 1).
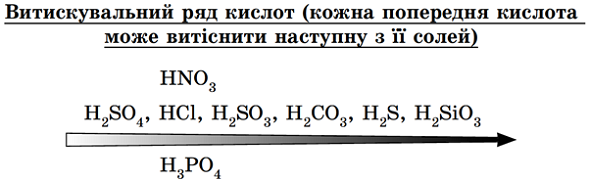
Рис. 1. Витискувальний ряд кислот
Карбон(IV) оксид можна добути дією сильної хлоридної кислоти на сіль слабкої та нестійкої карбонатної кислоти:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні класи органічних сполук. Фізичні властивості органічних речовин.
Завдання скеровано на перевірку знання фізичних властивостей органічних речовин.
У завданні наведено формули фенолу, етанової кислоти, етанолу, гексану. Із-поміж цих речовин найвища температура кипіння у фенолу, який за температури 20–25 °С й атмосферного тиску перебуває у твердому стані, а решта речовин за цих умов є рідинами.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура спиртів.
Завдання скеровано на перевірку вміння називати насичені ациклічні спирти за систематичною номенклатурою.
Називати насичені ациклічні спирти за систематичною номенклатурою потрібно за алгоритмом, наведеним на схемі (рис. 1).
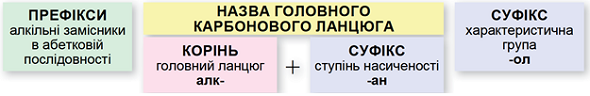
Рис. 1. Алгоритм побудови назв насичених ациклічних спиртів за систематичною номенклатурою
Важливо пам’ятати:
- потрібно нумерувати карбоновий ланцюг із того кінця, до якого ближче розташована гідроксильна група;
- якщо гідроксильна група рівновіддалена від обох кінців головного карбонового ланцюга, то нумерують із того кінця, до якого ближче розташований алкільний замісник;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, то його нумерують так, щоб замісник, назву якого за абеткою вживають раніше, був позначений найменшим числом;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, але з одного кінця замісників більше, то нумерацію проводять з урахуванням положення замісників, позначених найменшими числами.
Вибір головного ланцюга й нумерацію атомів Карбону в ньому за цим алгоритмом зображено на рисунку 2.
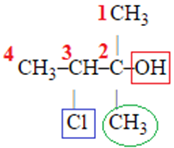
Рис. 2. Вибір головного ланцюга й нумерація атомів Карбону в ньому
У головному ланцюгу чотири атоми Карбону, із другим атомом Карбону в ньому сполучено характеристичну гідроксильну групу
Назва спирту – 2-метил-3-хлорoбутан-2-ол.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні поняття органічної хімії. Гомологія. Алкани.
Завдання скеровано на перевірку розуміння суті гомології та гомологічної різниці, уміння визначати формули членів гомологічного ряду.
Послідовний ряд сполук, кожен член у якому вiдрiзняється вiд сусiднього на однаковий атом чи ланку, зокрема на ланку
Гомологом метану є пропан
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами органічних сполук.
Речовина X у ланцюжку перетворень – етен
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні поняття органічної хімії. Гомологія. Алкіни.
Завдання скеровано на перевірку розуміння суті гомології та гомологічної різниці, уміння визначати формули членів гомологічного ряду.
Послідовний ряд сполук, кожен член у якому вiдрiзняється вiд сусiднього на однаковий атом чи ланку, зокрема на ланку
Загальна формула алкінів
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Типи реакцій в органічній хімії. Бензен.
Завдання скеровано на перевірку знання хімічних властивостей бензену й уміння складати хімічні реакції за його участі.
Гідрування бензену полягає в приєднанні молекул водню до молекули бензену:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Природні джерела вуглеводнів.
Завдання скеровано на перевірку знання галузей застосування алканів.
Головний складник природного газу – метан. У промисловості його використовують переважно як паливо, джерело енергії.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Спирти.
Завдання скеровано на перевірку знання якісних реакцій багатоатомних спиртів.
Етиленгліколь – двохатомний спирт. Характерною реакцією багатоатомних спиртів, яку використовують для їхнього виявлення, є утворення розчину синього кольору зі свіжодобутим купрум(ІІ) гідроксидом. Продукт реакції – сполука синього кольору.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Спирти. Альдегіди. Карбонові кислоти. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку знання хімічних властивостей спиртів, альдегідів і вміння встановлювати генетичні зв’язки між класами органічних сполук.
Умову завдання задовольняє речовина, яка належить до альдегідів.
Частковим окисненням етанолу добувають етаналь – речовину X. Частковим окисненням етаналю добувають етанову кислоту:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Карбонові кислоти.
Завдання скеровано на перевірку знання хімічних властивостей етанової кислоти.
Молекула карбонової кислоти утворена вуглеводневим залишком, сполученим з карбоксильною групою (однією чи кількома).
Етанова кислота у водному розчині дисоціює:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Естери.
Завдання скеровано на перевірку розуміння суті реакції естерифікації.
Естери – продукти реакції між карбоновою кислотою і спиртом. Унаслідок реакції між етановою кислотою і метанолом утворюються метилетаноат (X) і вода.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Вуглеводи.
Завдання скеровано на перевірку знання фізичних властивостей вуглеводів.
У воді розчиняються моносахарид глюкоза і дисахарид сахароза.
Полісахариди крохмаль і целюлоза не розчиняються у воді.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Аміни.
Завдання скеровано на перевірку знання хімічних властивостей амінів.
Аміни – органічні основи. Вони реагують з кислотами з утворенням солей, метанамін, наприклад, взаємодіє з гідроген хлоридом:
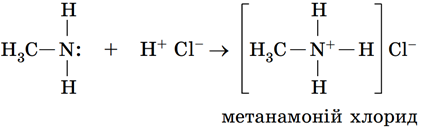
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Амінокислоти.
Завдання скеровано на перевірку знання складу й хімічних властивостей амінокислот.
Зв’язок між залишками амінокислот називають пептидним (або амідним) зв’язком, а групу 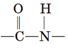 пептидною (або амідною) групою. Молекули амінокислот взаємодіють між собою. У реакцію поліконденсації вступають протилежні за функціями групи: карбоксильна група
пептидною (або амідною) групою. Молекули амінокислот взаємодіють між собою. У реакцію поліконденсації вступають протилежні за функціями групи: карбоксильна група
Високомолекулярними продуктами поліконденсації амінокислот є поліпептиди, низькомолекулярним – вода.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Високомолекулярні органічні сполуки.
Завдання скеровано на перевірку вміння визначати структурну ланку полімеру.
Полімери – високомолекулярні сполуки, молекули яких (макромолекули) складаються з великої кількості однакових угруповань, з’єднаних хімічними зв’язками. Ці групи атомів, які повторюються і становлять основу хімічної будови полімерного ланцюга, називають елементарними структурними ланками полімерів.
Поліпропілен є продуктом полімеризації пропену:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Кислотні оксиди. Кислоти. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між неорганічними сполуками, установлювати генетичні зв’язки між ними.
Сульфатну кислоти можна добути реакцією сульфур(VІ) оксиду з водою:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за хімічним складом і кількістю реагентів і продуктів.
У реакції 1 беруть участь дві складні речовини, утворюється одна складна речовина. Це реакція сполучення (Д).
У реакції 2 беруть участь дві складні речовини й утворюються дві складні речовини. Це реакція обміну (А).
У реакції 3 беруть участь проста та складна речовини й утворюються нові проста та складна речовини. Це реакція заміщення (Г).
У реакції 4 бере участь одна складна речовина, утворюються дві прості речовини. Це реакція розкладання (В).
Відповідь: 1Д, 2А, 3Г, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електролітична дисоціація.
Завдання скеровано на перевірку вміння прогнозувати електролітичну дисоціацію лугів, кислот, солей.
| 1 | Кисла сіль |
|
B |
| 2 | Одноосновна кислота |
|
A |
| 3 | Луг |
|
Г |
| 4 | Багатоосновна кислота |
|
Б |
Відповідь: 1В, 2А, 3Г, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкени. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння прогнозувати реагенти і продукти реакцій за участі етену.
| Назва речовини | Рівняння реакції | Природа продукту реакції | ||
| 1 | водень |
|
алкан | A |
| 2 | хлор |
|
дихлороалкан | Д |
| 3 | гідроген хлорид |
|
хлороалкан | Г |
| 4 | вода |
|
одноатомний спирт | B |
Відповідь: 1А, 2Д, 3Г, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні класи органічних сполук. Характеристичні (функціональні) групи.
Завдання скеровано на перевірку вміння класифікувати органічні сполуки.
Характеристична група – це атом або група атомів, що визначає природу речовини, тобто її належність до певного класу органічних сполук, і зумовлює її найхарактерніші хімічні властивості (рис. 1).
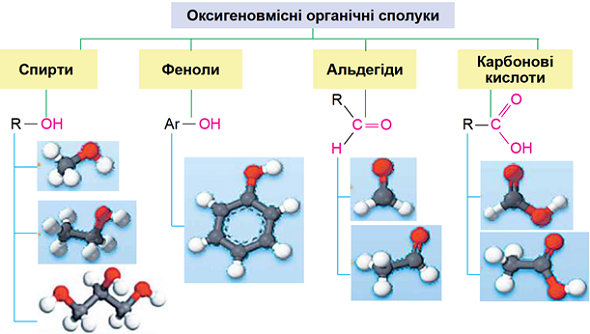
Рис. 1. Деякі представники оксигеновмісних органічних речовин
| Формула сполуки | Назва сполуки | Клас органічних сполук | ||
| 1 |
|
пропанова кислота | карбонова кислота | Б |
| 2 |
|
1,2-етандіол | спирт | Д |
| 3 |
|
етилетаноат | естер | Г |
| 4 |
|
етаналь | альдегід | A |
Відповідь: 1Б, 2Д, 3Г, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Будова атомів.
Завдання скеровано на перевірку знання закономірностей зміни в періодичній системі кількості енергетичних рівнів в атомах.
Кількість енергетичних рівнів в атомі хімічного елемента дорівнює кількості енергетичних рівнів у його атомі.
| Символ хімічного елемента | Номер періоду в періодичній системі хімічних елементів | Кількість енергетичних рівнів в атомі | ||
| A | 1 | 1 | 1 | |
| Б | 2 | 2 | 2 | |
| B | 4 | 4 | 4 | |
| Г | 3 | 3 | 3 |
Відповідь: А, Б, Г, В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни металічних і неметалічних властивостей хімічних елементів у періодичній системі.
Окиснювальні властивості хімічних елементів у періодах зростають зі збільшенням протонного числа, а в групах – зменшуються (рис. 1).

Рис. 1. Елементи другого та третього періодів періодичної системи хімічних елементів
Відповідь: А, Б, Г, В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Генетичний зв’язок між основними класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичний зв’язок між неорганічними сполуками різних класів.
Послідовність перетворень амоніаку на нітратну кислоту така:
Відповідь: Г, А, Б, В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами сполук.
A
Б
В
Г
Відповідь: Г, А, Б, В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Генетичний зв’язок між основними класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичний зв’язок між органічними сполуками різних класів.
Послідовність перетворень сполук під час синтезу фенолу така:
Відповідь: А, Б, Г, В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Генетичний зв’язок між основними класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичний зв’язок між органічними сполуками різних класів.
Послідовність перетворень сполук у ланцюжку перетворень алкану на спирт така:
Відповідь: А, Б, Г, В.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів –
Відповідь: 12.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати масу продукту реакції за хімічним рівнянням, якщо один із реагентів узято в надлишку.
Дано:
Знайти:
Етанова кислота в надлишку.
Відповідь: 37.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Виведення хімічної формули.
Завдання скеровано на перевірку вміння визначати хімічну формулу вищого оксиду за місцем елемента в періодичній системі хімічних елементів.
Порядковий номер 33 в періодичній системі хімічних елементів має Арсен. Це елемент 5А (15) групи. На зовнішньому енергетичному рівні в атомі Арсену п’ять електронів. Загальна формула вищих оксидів елементів цієї групи
Відповідь: 7.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати об’єм газуватого реагенту за відомою масою продукту реакції.
Дано:
Знайти:
Відповідь: 672.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати ступінь електролітичної дисоціації.
Ступінь дисоціації – відношення кількості молекул, які розпалися на йони, до загальної їхньої кількості.
Відповідь: 20.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати масу продукту реакції за масою реагенту.
Дано:
Знайти:
Відповідь: 142.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати об’єм газуватого продукту реакції за масою реагенту.
Дано:
Знайти:
Відповідь: 56.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 18
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати практичну масу продукту реакції за відомою кількістю речовини реагенту й відносним виходом продукту.
Дано:
Знайти:
Відповідь: 492.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати масу реагенту за об’ємом газуватого продукту реакції.
Дано:
Знайти:
Відповідь: 450.
Знайшли помилку? Пишіть на




