ЗНО онлайн 2013 року з хімії – пробний тест
Тестові завдання пробного тесту ЗНО 2013 року з хімії
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
За наведеною в умові завдання формулою можна визначити кількість видів атомів (хімічних елементів) у кожній речовині:
А один хімічний елемент (
Б два хімічні елементи (
В три хімічні елементи (
Г два хімічні елементи (
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Відносна густина.
Завдання скеровано на перевірку розуміння змісту поняття «Відносна густина газу».
Відносна густина
Відповідно за формулою
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Періодичний закон і періодична система хімічних елементів. Металічні й неметалічні елементи.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
Періодична система хімічних елементів - це графічний вираз періодичного закону. Структурними одиницями періодичної системи є періоди і групи хімічних елементів.
Періодом називають фрагмент природного ряду хімічних елементів, у якому вони розташовані переважно за зростанням атомних мас. На початку кожного періоду (окрім першого) лужний елемент, наприкінці – інертний.
У періодах зі збільшенням атомних мас металічний характер елементів послаблюється, а неметалічний – посилюється.
До головних підгруп належать елементи малих періодів та їхні аналоги з великих періодів. Поміж елементів головних підгруп є як металічні, так і неметалічні. У головних підгрупах зі зростанням атомних мас поступово посилюється металічний і послаблюється неметалічний характер елементів. Побічні підгрупи утворені елементами лише великих періодів. Усі ці елементи – металічні.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Будова атома. Нукліди. Ізотопи.
Завдання скеровано на перевірку вміння аналізувати склад нуклідів.
Нуклідний символ – символ нукліда хімічного елемента, біля якого зазначено масове число, як лівий верхній індекс і атомний номер, як лівий нижній
| Ознака порівняння | Нуклідний символ | ||
| Висновок | |||
| Заряд ядра (дорівнює протонному числу й порядковому номеру в періодичній системі) | +8 | +8 | Мають однаковий заряд ядра |
| Кількість електронів (дорівнює протонному числу) | 8 | 8 | Містять однакову кількість електронів |
| Нуклонне число (дорівнює сумі кількості протонів і нейтронів) | 16 | 18 | Мають різні нуклонні числа |
| Кількість нейтронів (дорівнює різниці нуклонного й протонного чисел) | 8 (16 – 8) |
10 (18 – 8) |
Містять різну кількість нейтронів |
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Хімічний зв’язок.
Завдання скеровано на перевірку вміння аналізувати склад речовини й визначати тип хімічного зв’язку в ній.
Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується.
Зі зростанням протонного числа електронегативність хімічних елементів зростає в періодах і зменшується в підгрупах.
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Умову завдання задовольняє тетрахлорометан
Тобто зв’язки між атомами Карбону та Хлору ковалентні полярні (рис. 1).
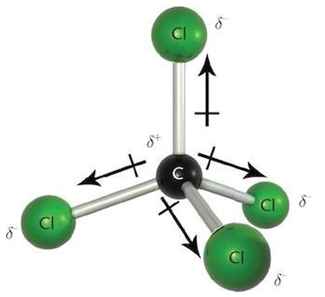
Рис. 1. Ковалентні полярні зв’язки в молекулі тетрахлорометану
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Періодичний закон і періодична система хімічних елементів. Будова атома.
Завдання скеровано на перевірку розуміння фізичного змісту порядкового номера хімічного елемента в періодичній системі, уміння визначати протонне число елемента.
Порядковий номер Літію в періодичній системі, а отже і його протонне число, дорівнює трьом.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Швидкість хімічних реакцій.
Завдання скеровано на перевірку вміння аналізувати залежність швидкості хімічної реакції від різних чинників.
Швидкість хімічної реакції – це швидкість утворення її продуктів або витрачання реагентів.
Зі зростанням температури хімічні реакції переважно пришвидшуються. Це зумовлено збільшенням умісту активних молекул (чи інших структурних частинок) у реакційній суміші. Натомість охолодження уповільнює взаємодію між реагентами. Саме тому харчові продукти довше зберігаються за низьких температур.
Зі зменшенням концентрації реагентів зменшуватиметься частота зіткнень (у тому числі й активних) між їхніми частинками. Зі збільшенням концентрації реагентів зростає кількість зіткнень (активних також) між їхніми частинками. Відповідно швидкість хімічної реакції зі збільшенням концентрації реагентів збільшується.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
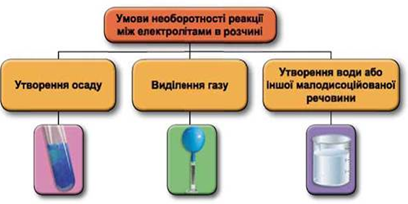
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Унаслідок змішування насичених водних розчинів натрій карбонату та барій хлориду утвориться осад барій карбонату:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Суміші.
Завдання скеровано на розуміння поняття «суміш».
Складники суміші зберігають свою індивідуальність, їх можна виділити з неї. Наприклад, суміш кварцового піску з водою можна розділити фільтруванням, суміш вуглеводнів – дистилюванням.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Розчини. Розчинення.
Завдання скеровано на перевірку розуміння природи теплових явищ під час розчинення.
Теплові явища, що супроводжують розчинення речовин, є наслідком взаємодії складників розчину. Молекули води руйнують зв’язки між частинками розчинюваної речовини – молекулами або йонами. Під час цього процесу утворюються продукти приєднання молекул води до частинок розчинюваної речовини – гідрати. На руйнування зв’язків між частинками розчинюваної речовини енергія (
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
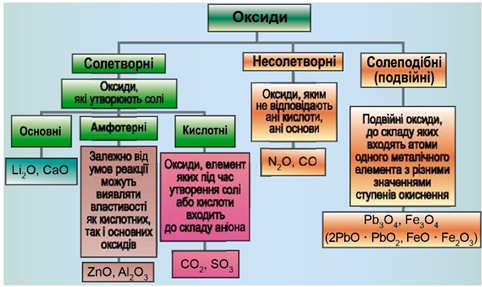
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію (
\(\mathrm{Mg – Ra}\) ); - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Ферум(ІІ) оксид є осно́вним, нітроген(І) оксид – несолетворний, нітроген(IV) оксид – кислотний, ферум(ІІІ) оксид – амфотерний.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Класифікація хімічних реакцій. Хімічні властивості натрію.
Завдання скеровано на перевірку знання фізичних і хімічних властивостей натрію, продуктів реакцій за його участі.
Реакцію натрію з водою можна описати хімічним рівнянням
Густина натрію (
Густина водню (
У розчині натрій гідроксиду, який утворився внаслідок реакції натрію з водою, фенолфталеїн набуває малинового кольору.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Електролітична дисоціація. Сильні та слабкі електроліти.
Завдання скеровано на перевірку вміння розпізнавати сильні та слабкі електроліти, складати й аналізувати рівняння електролітичної дисоціації.
Сульфатна й нітратна кислоти – сильні електроліти, у розведених розчинах практично повністю дисоціюють на йони:
Кількість речовини катіонів Гідрогену в розчині сульфатної кислоти вдвічі більша за її кількість речовини й становить
Етанова кислота – дуже слабкий електроліт, який незначною мірою дисоціює за рівнянням
Тобто катіонів Гідрогену в розведеному розчині етанової кислоти значно менше порівняно з іншими розчинами, про які йдеться в завданні.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійна (некарбонатна) твердість води зумовлена катіонами
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Амфотерні оксиди й гідроксиди.
Завдання скеровано на перевірку розуміння суті амфотерності.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або основні, або кислотні властивості. Наприклад, з кислотами гідроксиди Алюмінію та Цинку реагують як основи, з лугами – як кислоти.
На схемі 1 відображено реакцію цинку з хлоридною кислотою. На схемі 2 – добування цинк гідроксиду реакцією обміну між сіллю і лугом у водному розчині.
На схемах 3 й 4 відображено реакції цинк оксиду з кислотою і лугом відповідно, тобто його амфотерні властивості.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
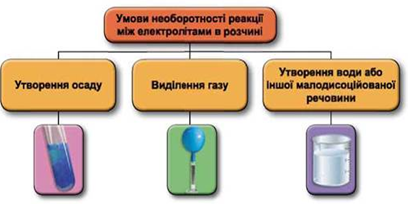
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Лише між калій нітратом і кальцій гідроксидом у водному розчині реакція не відбувається, оскільки всі речовини перебувають у розчині у вигляді йонів.
У варіантах відповіді А та В внаслідок реакцій утворюються осади ферум(ІІІ) гідроксиду й аргентум(І) хлориду відповідно.
У хімічній реакції між натрій карбонатом і нітратною кислотою (варіанті відповіді Б) виділяється газ.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Металічні елементи. Метали. Ряд активності металів. Корозія металів і способи захисту від неї.
Завдання скеровано на перевірку розуміння суті електрохімічної корозії металів, уміння порівнювати активність металів.
Одним зі способів захисту металевих конструкцій від морської води і ґрунтової корозії є використання протектора з активнішого металу.
Тобто протектором для заліза (головного складника сталі) є метал, розташований лівіше від нього в ряду активності металів (рис. 1).
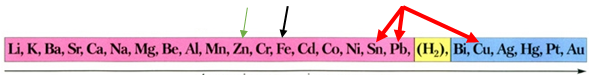
Активність металів зменшується
Рис. 1. Ряд активності металів
Умову завдання задовольняє цинк.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Солі.
Завдання скеровано на перевірку знання тривіальних назв деяких неорганічних речовин, зокрема солей.
Головний складник мармуру – кальцій карбонат, формула якого
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Алюміній оксид. Амфотерність.
Завдання скеровано на перевірку розуміння суті амфотерності, знання властивостей алюміній оксиду.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або основні, або кислотні властивості. Наприклад, з кислотами алюміній оксид реагує як основний, з лугами – як кислотний:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Сполуки Феруму(ІІ). Окисно-відновні реакції.
Завдання скеровано на перевірку знання властивостей сполук Феруму, уміння розпізнавати окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю.
Окиснення – утрачання електронів атомом або йоном, відновлення – процес, протилежний окисненню.
Окисники приєднують електрони, відновники – віддають.
Ферум є відновником у реакції ферум(ІІ) хлориду з хлором:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неметалічні елементи. Галогени.
Завдання скеровано на перевірку знання фізичних властивостей галогенів.
За нормальних умов
| Назва галогену | Температура плавлення, °C |
| Фтор | -220 |
| Хлор | -101 |
| Бром | -7 |
| Йод | -113,5 |
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Сполуки Сульфуру.
Завдання скеровано на перевірку знання властивостей сполук Сульфуру, уміння визначати ступені окиснення хімічних елементів за хімічними формулами.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Ступінь окиснення хімічного елемента в простій речовині дорівнює нулю.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Закон збереження маси. Хімічні рівняння.
Завдання скеровано на перевірку вміння застосовувати закон збереження маси для складання хімічних рівнянь.
Під час хімічних реакцій кількості атомів хімічних елементів не змінюються, тому маса реагентів дорівнює масі продуктів реакції.
Продуктом каталітичного окиснення амоніаку киснем є нітроген(ІІ) оксид і вода:
Сума коефіцієнтів у правій частині рівняння дорівнює
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Закон збереження маси. Хімічні рівняння.
Завдання скеровано на перевірку вміння застосовувати закон збереження маси для складання хімічних рівнянь.
Під час хімічних реакцій кількості атомів хімічних елементів не змінюються, тому маса реагентів дорівнює масі продуктів реакції. В умові завдання наведено схему перетворення, що спрощено відображає хімізм виробництва скла стопленням карбонатів Натрію і Кальцію з кварцовим піском. Газуватим продуктом цієї реакції є карбон(ІV) оксид:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Фізичні властивості органічних речовин.
Завдання скеровано на перевірку вміння аналізувати дані щодо температур плавлення і кипіння органічних речовин і робити висновок про їхній агрегатний стан за певних умов.
Умову завдання задовольняє речовина, температура плавлення якої вища за
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Типи хімічних реакцій в органічній хімії.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за участі органічних речовин.
Реакція приєднання – хімічна реакція, під час якої один або кілька подвійних чи потрійних зв’язків у ненасиченій сполуці перетворюються на ординарний (простий) зв’язок унаслідок приєднання інших атомів або груп.
Умову завдання задовольняє реакція приєднання водню до бензену:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкани.
Завдання скеровано на перевірку вміння розпізнавати хімічні формули алканів.
Алкани – насичені вуглеводні. Загальна формула алканів –
Умову завдання задовольняє формула гексану
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкени. Спирти. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку розуміння суті реакції дегідратації, знання способу добування етену, хімічних властивостей етанолу, уміння встановлювати генетичні зв’язки між класами органічних сполук.
Реакція дегідратації полягає у відщепленні молекул води від молекул неорганічних й органічних речовин.
Етен є продуктом дегідратації етанолу:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкіни. Якісні реакції органічних сполук.
Завдання скеровано на перевірку знання якісних реакцій на ненасичені вуглеводні.
Етин – ненасичений вуглеводень, у молекулі якого є потрійний зв’язок між атомами Карбону. Етин знебарвлює водний розчин калій перманганату.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Арени. Бензен.
Завдання скеровано на перевірку знання властивостей бензену й уміння встановлювати генетичні зв’язки між класами органічних сполук.
Бензен не можна добути гідруванням циклогексану, навпаки – гідрування бензену можна добути циклогексан:
Тримеризація етину – один зі способів добування бензену:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нафта. Перегонка нафти.
Завдання скеровано на перевірку знання суті перегонки нафти й продуктів її розділення на складники.
Продуктами перегонки нафти є бензин, лігроїн, мазут (рис. 1).
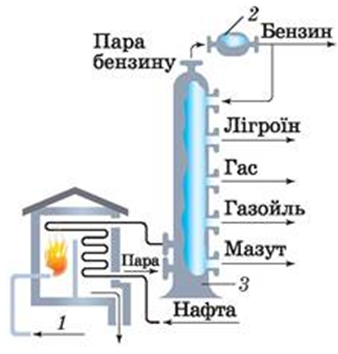
Рис. 1.Перегонка нафти
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Спирти. Гліцерол.
Завдання скеровано на перевірку знання структурної формули гліцеролу.
Гліцерол (1,2,3-пропантриол) – насичений триатомний спирт. Умову завдання задовольняє структурна формула, наведена у варіанті відповіді Г.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Метаналь. Метанол.
Завдання скеровано на перевірку розуміння суті реакції гідрування, знання властивостей метаналю і вміння встановлювати генетичні зв’язки між альдегідами й спиртами.
Реакція гідрування полягає в приєднанні молекул водню до молекул органічних речовин. Унаслідок приєднання молекули водню до молекули метаналю за місцем подвійного зв’язку між атомами Карбону й Оксигену утворюється молекула метанолу:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Метанова кислота. Якісні реакції органічних сполук.
Завдання скеровано на перевірку розуміння суті реакції гідрування, знання властивостей метаналю і вміння встановлювати генетичні зв’язки між альдегідами й спиртами.
Молекула метанової кислоти містить не лише карбоксильну, а й альдегідну групу (рис. 1), тому відновлює срібло з амоніачного розчину аргентум(І) оксиду.
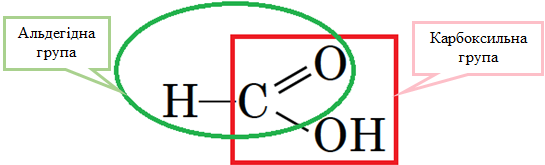
Рис. 1. Структурна формула метанової кислоти
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Жири.
Завдання скеровано на перевірку знання властивостей жирів і розуміння суті реакції гідрування.
Реакція гідрування пов’язана з перетворенням рідких жирів (олій) на тверді, які використовують у виробництві харчового маргарину – замінника вершкового масла. Під час гідрування олій відбувається приєднання атомів Гідрогену за місцями подвійних зв’язків у залишках карбонових кислот (рис. 1).
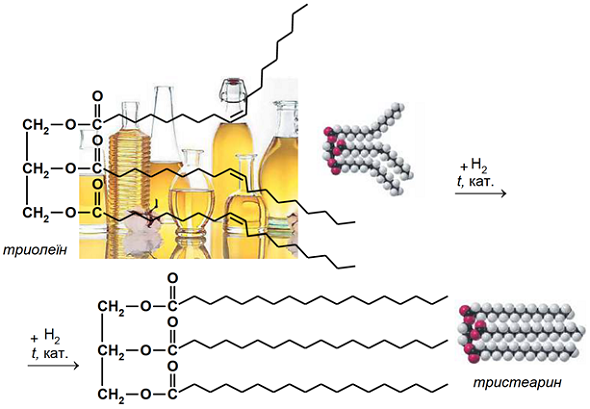
Рис. 1. Гідрування триолеїну
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи. Крохмаль.
Завдання скеровано на перевірку знання хімічного складу крохмалю.
Крохмаль – полісахарид. Кінцевим продуктом кислотного гідролізу крохмалю є глюкоза, із залишків якої складені його молекули.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Аміни.
Завдання скеровано на перевірку знання хімічних властивостей амінів і вміння складати реакції повного окиснення цих сполук.
Продуктами окиснення етанаміну є карбон(IV) оксид, вода й азот:
Відповідь: В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Амінокислоти. Білки.
Завдання скеровано на перевірку знання хімічного складу білків.
Білки – високомолекулярні органічні сполуки. Кінцевим продуктом гідролізу білків є амінокислоти. Із залишків амінокислот складені молекули білків.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Високомолекулярні органічні сполуки.
Завдання скеровано на перевірку вміння визначати формулу мономеру за структурною формулою полімеру.
Полівінілацетат (рис. 1) – продукт полімеризації вінілацетату (рис. 2) – естеру етанової (оцтової) кислоти й ненасиченого вінілового спирту.
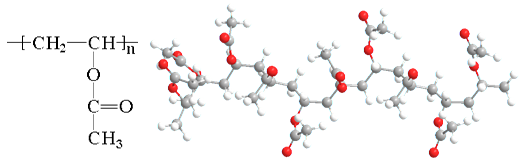
Рис. 1. Полівінілацетат. 1. Формула. 2. Модель фрагмента молекули
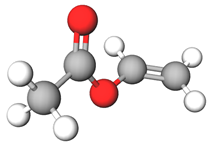
Рис. 2. Модель молекули вінілацетату
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкіни. Добування етину.
Завдання скеровано на перевірку знання способів добування етину, вміння встановлювати генетичні зв’язки між неорганічними й органічними речовинами.
Один зі способів добування етину є дія води на кальцій етинид (карбід):
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за хімічним складом і кількістю реагентів і продуктів.
У реакції (1) беруть участь дві складні речовини й утворюються дві складні речовини. Це реакція обміну (B).
У реакції (2) беруть участь дві складні речовини, утворюється одна складна речовина. Це реакція сполучення (Д).
У реакції (3) беруть участь проста та складна речовини й утворюються нові проста та складна речовини. Це реакція заміщення (A).
У реакції (4) бере участь одна складна речовина, утворюються дві складні речовини. Це реакція розкладання (Г).
Відповідь: 1В, 2Д, 3А, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Речовина. Матеріал.
Завдання скеровано на перевірку вміння розпізнавати речовини – складники матеріалів.
Головним складником деревини 1 є целюлоза (Б).
Прикладом металу 2 є залізо (Д).
Прикладом пластмаси 3 є поліпропілен (А).
Головним складником кварцового скла 4 є силіцій(IV) оксид (Г).
Відповідь: 1Б, 2Д, 3А, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія.
Завдання скеровано на перевірку вміння розпізнавати органічні речовини за їхніми формулами.
Хімічна формула фенолу 1 –
Хімічна формула бензену 2 –
Хімічна формула пропаналю 3 –
Хімічна формула бут-1-ину 4 –
Відповідь: 1Б, 2А, 3В, 4Д.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки.
Завдання скеровано на перевірку вміння розпізнавати нітрогеновмісні органічні сполуки за їхніми формулами.
1 – хімічна формула аніліну, ароматичного аміну (Д).
2 – хімічна формула етилдиметиламіну, третинного аміну (B).
3 – хімічна формула 4-амінобутанової кислоти (A).
4 – хімічна формула дипептиду (Г), утвореного залишками аміноетанової кислоти.
Відповідь: 1Д, 2В, 3А, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати кількість електронів на зовнішньому енергетичному рівні атома.
Кількість електронів на зовнішньому енергетичному рівні атомів елементів головних підгруп збігається з номером групи елемента в періодичній системі (короткоперіодний варіант).
Хлор – хімічний елемент VІІА групи, Селен – VІА групи, Бор – ІІІА групи, Літій – ІА групи.
Відповідь: 1Г, 2В, 3Б, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Радіус атома.
Завдання скеровано на перевірку знання закономірностей зміни радіусів атомів хімічних елементів у групах і періодах періодичної системи.
Радіус атома – це відстань від центра його ядра до сферичної поверхні, на якій найчастіше трапляються електрони зовнішнього енергетичного рівня.
У періодах зі зростанням протонного числа радіус атомів зменшується.
У головних підгрупах зі зростанням протонного числа радіус атомів зростає (рис. 1).
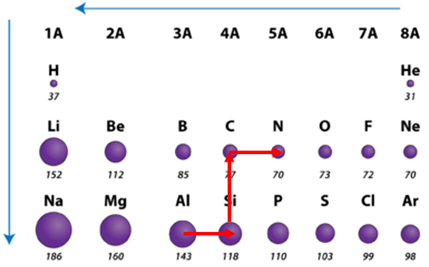
Рис. 1. Закономірності зміни радіусів атомів у періодах і групах періодичної системи
Відповідь: 1А, 2Б, 3В, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Неорганічна хімія. Генетичні зв’язки між основними класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між основними класами неорганічних сполук.
Ланцюжок перетворень неметалу на кислу сіль такий:
Відповідь: 1Г, 2Б, 3В, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Неорганічна хімія. Генетичні зв’язки між основними класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між основними класами неорганічних сполук.
Ланцюжок перетворень солі безоксигенової кислоти на середню сіль такий:
Відповідь: 1Г, 2Б, 3А, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між основними класами органічних сполук, неорганічними й органічними речовинами.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між основними класами органічних сполук.
Ланцюжок перетворень неорганічної речовини на спирт:
Відповідь: 1В, 2Г, 3Б, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між основними класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між основними класами органічних сполук.
Ланцюжок перетворень неорганічної речовини на спирт:
Відповідь: 1Г, 2А, 3В, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою відновника –
Відповідь: 2.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Номенклатура алканів.
Завдання скеровано на перевірку вміння називати алкани за систематичною номенклатурою.
Сполуці певної будови відповідає лише одна систематична назва, за якою можна уявити й відтворити будову сполуки, тобто її структурну формулу. Алгоритм побудови назв алканів за систематичною номенклатурою наведено на схемі (рис. 1). Назви алкільних замісників утворюють заміною суфікса -ан у назві алкану на суфікс -ил (-іл). Кількість однакових алкільних замісників позначають множинними префіксами. Два однакові замісники позначають префіксом ди-, три – префіксом три-, чотири – тетра-, п’ять – пента- тощо. Перед приголосними потрібно писати ди-, перед голосними – ді: диметил, але діетил.

Рис. 1. Алгоритм побудови назв алканів за систематичною номенклатурою
В алкані, структурну формулу якого наведено в завданні, сім атомів Карбону в головному ланцюгу, до четвертого приєднані два вуглеводневі замісники, до другого – атом Хлору (рис. 2).
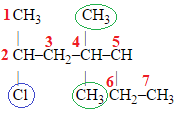
Рис. 2. Структурна формула 4,4-диметил-2-хлорогептану
Відповідь: 442.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини.
Дано:
Знайти:
Відповідь: 222.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами. Молярний об’єм газів.
Завдання скеровано на перевірку вміння обчислювати об’єм газу за його масою.
Дано:
Знайти:
Відповідь: 56.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення об’ємної частки газу в суміші.
Завдання скеровано на перевірку вміння обчислювати об’ємну частку газу в суміші.
Дано:
Знайти:
Відповідь: 25.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати об’єми газуватих продуктів і реагентів за хімічними рівняннями.
Дано:
Знайти:
Відповідь: 36.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати за хімічними рівняннями масу продукту реакції, якщо один з реагентів узято в надлишку.
Дано:
Знайти:
За рівнянням реакції
У реакції повністю витратиться барій нітрат, сульфатна кислота в надлишку.
Відповідь: 233.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розчини. Масова частка розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масу складника розчину за його масовою часткою.
Дано:
Знайти:
Відповідь: 640.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення масової частки складника в суміші.
Завдання скеровано на перевірку вміння обчислювати масову частку складника в суміші.
Дано:
Знайти:
Відповідь: 65.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Виведення молекулярної формули речовини.
Завдання скеровано на перевірку вміння виводити молекулярну формулу речовини за даними щодо продуктів її згоряння і відносною густиною пари.
Дано:
Знайти:
Відповідь: 12.
Знайшли помилку? Пишіть на




