ЗНО онлайн 2012 року з хімії – пробний тест
ТЕМА: Періодичний закон і періодична система хімічних елементів. Будова атома.
Завдання скеровано на перевірку вміння визначати протонне число й будову зовнішнього енергетичного рівня атома за місцем хімічного елемента в періодичній системі.
За умовою в атомі хімічного елемента шість електронів на зовнішньому енергетичному рівні. Тобто це елемент 6А (16) групи періодичної системи.
Умову завдання з-поміж наведених задовольняє елемент із протонним числом 16 Сульфур.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння інтерпретувати нуклідні символи атомів і простих йонів.
Нуклід – це різновид атомів або йонів з однаковим масовим числом (кількість нуклонів) та атомним номером (кількістю протонів).
Нуклідним символом називають символ нукліда елемента, біля якого зазначено атомний номер як лівий підрядковий, а масове число – як лівий надрядковий індекс.
Нуклони – це протони й нейтрони. Кількість нейтронів у ядрі дорівнює різниці між масовим і протонним числами.
Умову завдання задовольняє варіант відповіді Б: порядковий номер Фосфору в періодичній системі хімічних елементів
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів хімічних елементів.
Умовний запис будови електронних оболонок атомів називають електронною формулою. Наведена в умові формула вищого оксиду
Умову завдання задовольняє електронна формула
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Протонне число.
Завдання скеровано на перевірку вміння визначати будову атома за місцем хімічного елемента в періодичній системі.
За кількістю електронів на зовнішньому енергетичному рівні можна дійти висновку, що йдеться про хімічний елемент ІІІА (13) групи. Тобто формула його гідроксиду
Відносна атомна маса елемента ІІІА (13) групи Алюмінію –
Його порядковий номер і, відповідно, протонне число, –
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Групи хімічних елементів.
Завдання скеровано на перевірку знання структури періодичної системи.
До однієї підгрупи IVA (14) належать Силіцій

Рис. 1. Силіцій
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння порівнювати будову атомів хімічних елементів того самого періоду.
У періодах зі зростанням протонного числа збільшується кількість електронів на зовнішньому енергетичному рівні атомів хімічних елементів. Ця закономірність справедлива й для елементів 3 періоду (рис. 1).

Рис. 1. Будова зовнішнього енергетичного рівня атомів хімічних елементів 3 періоду
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Форми і перекривання електронних хмар. Хімічний зв’язок.
Завдання скеровано на перевірку вміння визначати тип і спосіб утворення хімічного зв’язку.
У молекулі гідроген хлориду сполучені атом Гідрогену й атом Хлору. Хімічний зв’язок між ними утворюється за рахунок перекривання s-електронної хмари атома Гідрогену та p-електронної хмари атома Хлору (рис. 1).
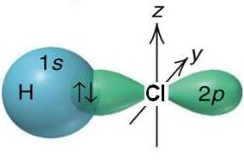
Рис. 1. Перекривання електронних хмар в молекулі гідроген хлориду
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Хімічний зв’язок.
Завдання скеровано на перевірку вміння визначати тип хімічного зв’язку у речовинах.
Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується.
Зі зростанням протонного числа електронегативність хімічних елементів зростає в періодах і зменшується в підгрупах.
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
У молекулі гідроген сульфіду
Тобто зв’язки між атомами Сульфуру й Гідрогену ковалентні полярні.
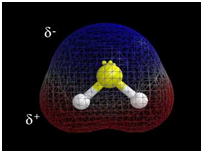
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти.
Завдання скеровано на перевірку вміння класифікувати кислоти.
Хлоридна кислота – водний розчин гідроген хлориду
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні й органічні речовини, їхні властивості.
Завдання скеровано на перевірку знання властивостей водню, метану, гідроген хлориду, амоніаку, етену, кисню, азоту, нітроген(I) оксиду, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею (див. рисунок).
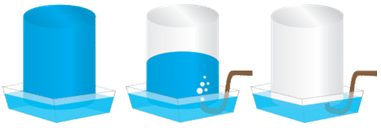
Із-поміж наведених у завданні речовин добре розчинним є амоніак. Тому його не збирають витісненням води.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окисно-відновних реакцій ступені окиснення хімічних елементів змінюються.
Відновник віддає електрони й окиснюється.
Окисник приєднує електрони й відновлюється.
Азот є відновником у реакції з киснем:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Закон збереження маси речовин. Хімічні рівняння. Нітрати.
Завдання скеровано на перевірку знання продуктів термічного розкладання нітратів залежно від положення металу в ряду активності й уміння застосовувати закон збереження маси речовин під час хімічних реакцій для складання рівнянь реакцій.
Продукти термічного розкладання нітратів залежно від положення металу в ряду активності наведено на рисунку 1.
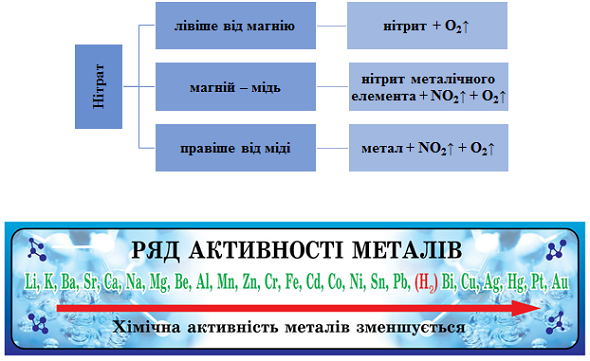
Рис. 1. Продукти термічного розкладання нітратів залежно від положення металу в ряду активності
Сума коефіцієнтів рівняння термічного розкладання купрум(ІІ) оксиду дорівнює
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Оксиди. Кислоти. Електролітична дисоціація.
Завдання скеровано на перевірку знання хімічних властивостей кислотних оксидів і продуктів електролітичної дисоціації кислот.
Сульфітна кислота дисоціює на катіони Гідрогену й сульфіт-аніони:
Хлоридна кислота дисоціює на катіони Гідрогену й хлорид-аніони:
Продуктом розчинення сульфур(VI) оксиду у воді є сульфатна кислота, яка дисоціює на катіони Гідрогену й сульфат-аніони:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини. Органічні речовини.
Завдання скеровано на перевірку знання промислових способів добування неорганічних й органічних речовин.
Метан виокремлюють із природного газу.
Етин добувають термічним розкладанням метану.
Гідроген хлорид синтезують із водню й хлору:
Кальцій оксид добувають випалюванням вапняку.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Йонні рівняння.
Завдання скеровано на перевірку вміння за скороченими йонно-молекулярними рівняннями відтворювати молекулярні.
Скорочене йонне рівняння
Реакція нейтралізації – це реакція між основою і кислотою з утворенням солі та води.
Умову завдання задовольняє пара речовин «натрій гідроксид і нітратна кислота».
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Хімічні реакції.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за різними ознаками.
Унаслідок реакції між двома складними речовинами (амоніаком і гідроген хлоридом) утворюється одна складна речовина (амоній хлорид):
Це реакція сполучення.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окисно-відновних реакцій ступені окиснення хімічних елементів змінюються.
Відновник віддає електрони й окиснюється.
Окисник приєднує електрони й відновлюється.
Купрум є відновником у реакції купрум(І) оксиду з киснем:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Оксиди. Амфотерність.
Завдання скеровано на перевірку розуміння суті амфотерності й уміння розпізнавати амфотерні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
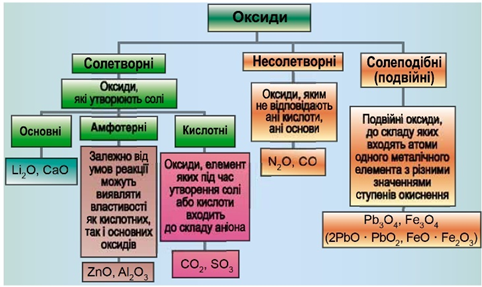
Рис. 1. Класифікація оксидів
Ферум(ІІ) оксид основний, а алюміній оксид амфотерний.
Основні оксиди реагують з кислотами й не реагують із лугами.
Амфотерні оксиди реагують і з кислотами, і з лугами.
Якщо додати до суміші цих двох оксидів розчин лугу й профільтрувати, прореагує і перейде в розчин лише алюміній оксид, а на фільтрі залишиться ферум(ІІ) оксид.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Метали. Залізо. Кислоти. Сульфатна кислота.
Завдання скеровано на перевірку знання хімічних властивостей заліза й сульфатної кислоти.
Нітратна й сульфатна кислоти виявляють хімічні властивості, загальні для всіх кислот, а також особливі. Вони – кислоти-окисники не лише за катіонами Гідрогену, а й за атомами Гідрогену й Сульфуру відповідно. Продукти реакцій нітратної та сульфатної кислот із металами залежать від положення металів у ряду активності, масової частки кислоти у розчині, температури тощо (рис. 1).
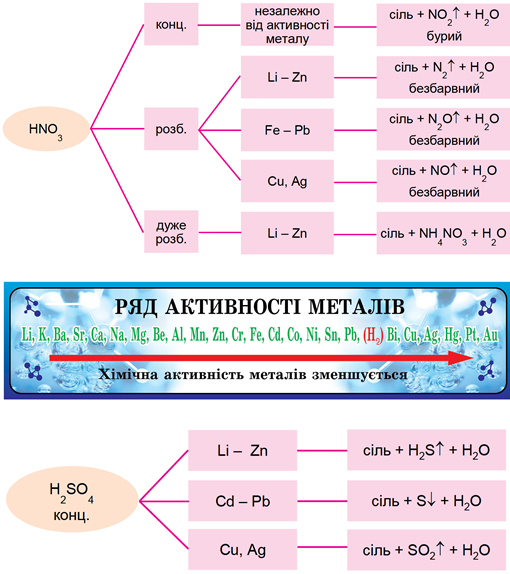
Рис. 1. Продукти реакцій нітратної і сульфатної кислот з металами залежно від положення металу в ряду активності
Умову завдання задовольняє розведена сульфатна кислота:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Кислотні оксиди. Кислоти.
Завдання скеровано на перевірку розуміння поняття «кислотні дощі» й хімізму їхнього утворення.
Кислотні опади утворюються внаслідок гідратації кислотних оксидів, які містяться в повітрі:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Метали.
Завдання скеровано на перевірку вміння порівнювати активність металів.
Для порівняння активності металів потрібно використати їхній ряд активності (рис. 1).

Рис. 1. Ряд активності металів
Мідь у цьому ряду розташована правіше за інші метали, про які йдеться в завданні.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
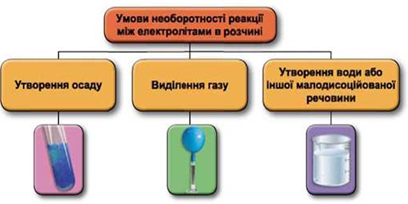
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Унаслідок змішування насичених водних розчинів барій нітрату й натрій сульфату утвориться осад барій сульфату:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Алотропія. Кисень. Озон.
Завдання скеровано на перевірку розуміння алотропії та знання алотропних форм Оксигену.
Алотропія – явище існування одного хімічного елемента у вигляді кількох простих речовин з різними властивостями – алотропних видозмін (модифікацій).
Алотропні модифікації здатні взаємоперетворюватися. Кисень
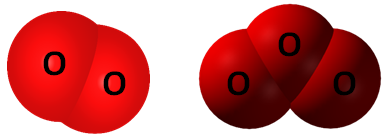
Рис. 1. Моделі молекул алотропних видозмін Оксигену: кисень
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Залізо. Закон збереження маси речовин. Хімічні рівняння.
Завдання скеровано на перевірку знання хімізму виробництва заліза із залізної руди й уміння застосовувати закон збереження маси речовин під час хімічних реакцій для складання рівнянь реакцій.
У завданні йдеться про випалювання залізного колчедану – першу стадію виробництва заліза із залізної руди:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Суміші. Способи розділення сумішей.
Завдання скеровано на перевірку вміння добирати спосіб розділення суміші з огляду на властивості її складників.
Морська вода – розчин солей. Суміш можна розділити дистилюванням: вода внаслідок нагрівання випаровується і конденсується, а розчинені в ній солі – ні.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння класифікувати оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
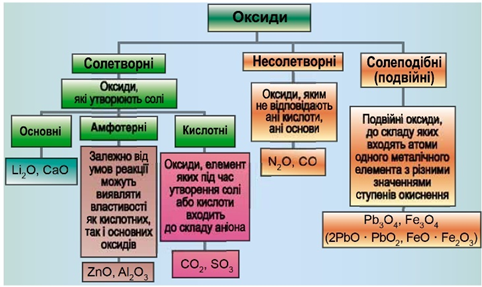
Рис. 1. Класифікація оксидів
Ферум(ІІ) оксид – основний. Карбон(IV) оксид і нітроген(V) оксид – кислотні. Цинк оксид – амфотерний.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи органічних сполук. Нітрогеновмісні органічні сполуки. Білки.
Завдання скеровано на перевірку вміння розпізнавати речовини білкової природи.
Гемоглобін – складний ферумовмісний білок еритроцитів, що забезпечує транспорт дихальних газів в організмі тварин і людини (рис. 1).
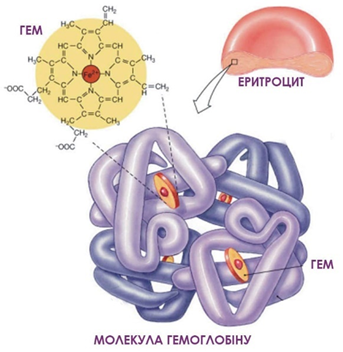
Рис. 1. Гемоглобін – білок складної будови
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Основні поняття органічної хімії. Первинні, вторинні, третинні атоми Карбону.
Завдання скеровано на перевірку вміння розрізняти первинні, вторинні, третинні атоми Карбону.
Атоми Карбону в органічних сполуках поділяють на:
- первинні – сполучені з одним Карбоном,
- вторинні – сполучені з двома атомами Карбону,
- третинні – сполучені з трьома атомами Карбону,
- четвертинні – сполучені з чотирма атомами Карбону.
Третинний атом Карбону позначено буквою Б.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Типи кристалічних ґраток.
Завдання скеровано на перевірку вміння прогнозувати тип кристалічних ґраток у речовині за її властивостями.
Описані властивості – низька температура плавлення, леткість властиві речовинам з молекулярними кристалічними ґратками. Сили притягання між молекулами у вузлах кристалічних ґраток слабкі, тому речовина має порівняно низькі температури плавлення і кипіння, легко випаровується.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Типи реакцій в органічній хімії.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за участі органічних сполук.
Дегідратація – відщеплення молекули води від молекули речовини.
Гідрування – приєднання молекули водню до молекули речовини.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нафта. Перегонка нафти.
Завдання скеровано на перевірку знання суті перегонки нафти й продуктів її розділення на складники.
Продуктом перегонки нафти є мазут (рис. 1).
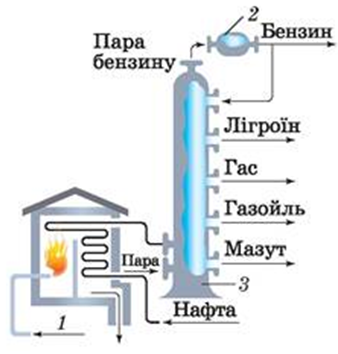
Рис. 1. Перегонка нафти
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами органічних сполук.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Типи реакцій в органічній хімії. Алкани.
Завдання скеровано на перевірку знання хімічних властивостей алканів і вміння класифікувати хімічні реакції за їхньої участі.
Бутан є представником насичених вуглеводнів – алканів.
Алканам властиві реакції повного окиснення (горіння), заміщення, ізомеризації (починаючи від бутану).
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи. Крохмаль.
Завдання скеровано на перевірку знання хімічних властивостей крохмалю.
Декстрини – це група вуглеводів з низькою молекулярною масою, що утворюються в результаті гідролізу крохмалю.
Кінцевим продуктом гідролізу крохмалю є моносахарид глюкоза.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Фенол.
Завдання скеровано на перевірку знання якісних реакцій органічних речовин.
Фенол знебарвлює бромну воду, утворюється білий осад 2,4,6-трибромофенолу:
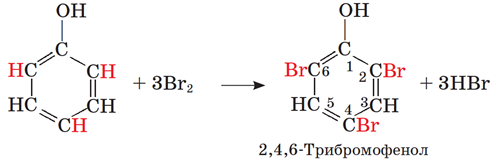
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Арени.
Завдання скеровано на перевірку вміння розпізнавати структурні формули ароматичних вуглеводнів.
Арени – вуглеводні, що містять принаймні одне ароматичне кільце (рис. 1) – плоску циклічну структуру, де атоми Карбону сполучені між собою ароматичними зв’язками, проміжними за довжиною і деякими іншими характеристиками між подвійним (ненасиченим) і ординарним (насиченим).
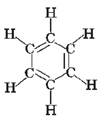
Рис. 1. Структурна формула бензену
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Аміни.
Завдання скеровано на перевірку вміння розпізнавати хімічну формулу аніліну.
У молекулі аніліну аміногрупа сполучена безпосередньо з фенільною групою (рис. 1).

Рис. 1. Формула аніліну
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічні й неорганічні речовини.
Завдання скеровано на перевірку знання фізіологічної дії деяких органічних і неорганічних речовин.
Кальцій карбонат – крейда.
Натрій хлорид – кухонна сіль.
Гліцерол – складник косметичних кремів.
Фенол – токсична речовина, він може спричинити опік шкіри.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічні й неорганічні речовини.
Завдання скеровано на перевірку знання хімічних властивостей органічних і неорганічних речовин.
Вибухонебезпечні суміші з повітрям утворюють водень, метан, етин.
У решті варіантів відповіді хоча б одна речовина не реагує з киснем повітря
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічні речовини. Ізомерія.
Завдання скеровано на перевірку розуміння суті ізомерії та вміння розпізнавати ізомери.
Ізомери – речовини з однаковою молекулярною і різними структурними формулами.
Умову завдання задовольняє варіант відповіді Б.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атомів хімічних елементів.
Кількість електронів на зовнішньому енергетичному рівні атомів елементів головних підгруп періодичної системи збігається з номером групи:
| Назва хімічного елемента | Номер групи | Електронна формула | ||
| 1 | Сульфур | VIА | B | |
| 2 | Хлор | VIIА | Б | |
| 3 | Магній | IIА | A | |
| 4 | Калій | IА | Г |
Відповідь: В, Б, А, Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння класифікувати неорганічні речовини.
1
2
3
4
Відповідь: Б, А, Д, Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічні й неорганічні речовини.
Завдання скеровано на перевірку вміння розпізнавати формули органічних і неорганічних речовин.
| Зображення моделі молекули речовини | Назва речовини | ||
| 1 | 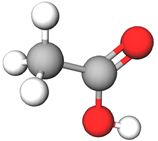 |
етанова кислота | Г |
| 2 | 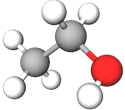 |
етанол | B |
| 3 | 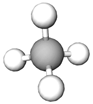 |
метан | Д |
| 4 | 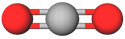 |
карбон(IV) оксид | A |
Відповідь: Г, В, Д, А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Структура періодичної системи хімічних елементів. Групи хімічних елементів.
Завдання скеровано на перевірку вміння розпізнавати представників груп елементів у періодичній системі.
| 1 | Лужні елементи належать до ІА групи періодичної системи | B | |
| 2 | Лужноземельні елементи належать до ІІА групи періодичної системи | Д | |
| 3 | Галогени належать до VIІА групи періодичної системи | Г | |
| 4 | Інертні елементи належать до VIIІА групи періодичної системи | Б |
Відповідь: В, Д, Г, Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Обчислення в хімії. Відносна густина газів.
Завдання скеровано на перевірку розуміння фізичного змісту відносної густини газів й уміння застосовувати наслідки із закону Авогадро.
Відносна густина D газуватої речовини X за газуватою речовиною Y дорівнює відношенню густин ρ цих газів, виміряних за однакових умов. Оскільки молярні об’єми газів за однакових умов рівні, для порівняння відносних густин газів достатньо порівняти їхні молярні маси, які чисельно дорівнюють відносним молекулярним масам:
Відповідь: А, В, Г, Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння порівнювати кількість енергетичних рівнів в електронній оболонці атомів за місцем хімічних елементів у періодичній системі.
Кількість енергетичних рівнів в електронній оболонці атома збігається з номером періоду, до якого належить хімічний елемент.
| Символ хімічного елемента | Номер періоду | Кількість енергетичних рівнів в атомі | |
| 2 | 2 | Б | |
| 3 | 3 | A | |
| 4 | 4 | B | |
| 5 | 5 | Г |
Відповідь: Б, А, В, Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння порівнювати кількість електронів на зовнішньому енергетичному рівні атомів за місцем хімічних елементів у періодичній системі.
Кількість енергетичних рівнів в електронній оболонці атома збігається з номером періоду, до якого належить хімічний елемент.
| Символ хімічного елемента | Номер періоду | Кількість електронів на зовнішньому енергетичному рівні атома | |
| IA | 1 | Г | |
| VA | 5 | A | |
| VIA | 6 | B | |
| VIIA | 7 | Б |
Відповідь: Г, А, В, Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна й неорганічна хімія. Кислотні властивості органічних і неорганічних сполук.
Завдання скеровано на перевірку вміння порівнювати кислотні властивості органічних і неорганічних сполук.
З-поміж сполук, про які йдеться в задачі, найсильнішою є сильна неорганічна хлоридна кислота.
Етанова кислота є слабкою органічною кислотою.
Фенол (карболова кислота) виявляє слабкі кислотні властивості, зокрема реагує з лугами.
Атом Гідрогену в гідроксильній групі етанолу здатний заміщуватися атомами лужних елементів, тобто виявляє слабкі кислотні властивості.
Відповідь: Г, А, Б, В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами органічних сполук.
Ланцюжок перетворень неорганічної речовини на спирт:
Відповідь: Б, А, Г, В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами органічних сполук.
Відповідь: В, А, Б, Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Протонне число.
Завдання скеровано на перевірку вміння визначати протонне число хімічного елемента за його місцем у періодичній системі.
Кількість протонів в атомі дорівнює номеру хімічного елемента в періодичній системі.
Порядкові номери Магнію і Кальцію в періодичній системі
Відповідь: 32.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 25.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масу кристалізаційної води за масою кристалогідрату.
Дано:
Знайти:
Відповідь: 63.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт біля формули окисника –
Відповідь: 8.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення маси розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масу розчиненої речовини.
Дано:
Знайти:
Відповідь: 161.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення масової частки складника суміші. Комбіновані задачі.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 10.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення відносного виходу продукту реакції.
Завдання скеровано на перевірку вміння обчислювати відносний вихід продукту реакції.
Дано:
Знайти:
Відповідь: 75.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Комбіновані задачі.
Завдання скеровано на перевірку вміння застосовувати закон об’ємних відношень газів під час розв’язування комбінованих задач.
Дано:
Знайти:
Відповідь: 80.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Виведення формули сполуки за відношенням мас хімічних елементів у ній.
Завдання скеровано на перевірку вміння виводити формулу сполуки за відношенням мас хімічних елементів у ній.
Дано:
Знайти:
Відповідь: 19.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Об’ємні відношення газів у хімічних реакціях.
Завдання скеровано на перевірку вміння застосовувати закон об’ємних відношень газів під час розв’язування задач.
Дано:
Знайти:
Відповідь: 15.
Знайшли помилку? Пишіть на




