ЗНО онлайн 2017 року з хімії – додаткова сесія
Тестові завдання додаткової сесії ЗНО 2017 року з хімії
ТЕМА: Основні хімічні поняття. Речовина. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
За наведеною в умові завдання формулою можна визначити кількість видів атомів (хімічних елементів) у кожній речовині й співвідношення між ними:
А
Б
В
Г
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атомів і простих йонів.
Завдання скеровано на перевірку вміння інтерпретувати нуклідні символи простих йонів.
| Символ хімічного елемента | Порядковий номер хімічного елемента в періодичній системі |
Кількість електронів | |
| в атомі | у йоні | ||
| 12 | 12 | 10 | |
| 11 | 11 | 10 | |
| 4 | 4 | 2 | |
| 3 | 3 | 2 | |
| 9 | 9 | 10 | |
| 17 | 17 | 18 | |
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Будова атома. Радіус атома. Електронегативність.
Завдання скеровано на перевірку вміння аналізувати склад атомів і простих йонів, порівнювати електронегативність й радіуси атомів хімічних елементів з огляду на їхнє місце в періодичній системі.
| I | в атомі Сульфуру (елемент третього періоду) електрони перебувають на трьох енергетичних рівнях, а в атомі Оксигену – на двох, тож радіус атома Сульфуру більший за радіус атома Оксигену |
| II | порядковий номер Неону в періодичній системі 10, у ядрі його атома 10 протонів й 11 (21 – 10) нейтронів |
| III | Хлор – елемент третього періоду, а Бром – четвертого, тому електрони в атомі Хлору перебувають на трьох, а в атомі Брому – на чотирьох енергетичних рівнях |
| IV | у групах хімічних елементів у періодичній системі зі збільшенням протонних чисел зменшується електронегативність, тож електронегативність Нітрогену більша за електронегативність Фосфору |
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).
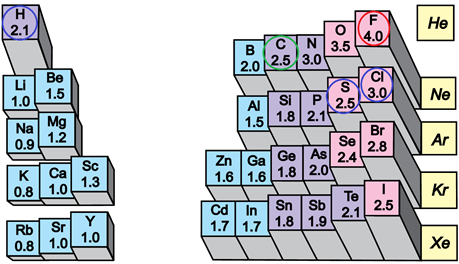
Рис. 1. Відносна електронегативність атомів хімічних елементів
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку тим більша, чим більша різниця електронегативностей атомів, між якими він утворюється.
Електронегативність Флуору найбільша порівняно з іншими хімічними елементами, тому і зв’язок
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки.
Завдання скеровано на перевірку розуміння змісту поняття кристалічні ґратки, уміння прогнозувати тип кристалічних ґраток за фізичними властивостями речовини.
У йонних кристалах зв’язки між йонами міцні, тому такі речовини зазвичай мають високі температури плавлення. Електропровідність розплаву літій гідриду свідчить, що структурними частинками його кристалічних ґраток є йони, які внаслідок руйнування ґраток за високої температури переходять у розплав і є носіями електричного струму.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Класифікація хімічних реакцій. Хімічні властивості й застосування кальцій оксиду.
Завдання скеровано на перевірку знання хімічних властивостей і застосування кальцій оксиду, уміння класифікувати хімічні реакції за кількістю і хімічним складом реагентів і продуктів, а також за тепловим ефектом.
Реакцію кальцій оксиду з водою можна описати хімічним рівнянням
У реакції реагентами є дві складні речовини, продуктом – одна складна, це реакція сполучення.
Частина води перетворюється на пару внаслідок того, що під час реакції виділяється теплова енергія, тобто реакція є екзотермічною.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні й органічні речовини, їхні властивості.
Завдання скеровано на перевірку знання властивостей нітроген(IV) оксиду, метану, амоніаку, гідроген броміду, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею (див. рисунок).
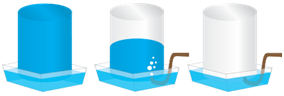
Із-поміж наведених у завданні речовин лише метан погано розчиняється у воді, тому цей газ збирають її витісненням.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Йонно-молекулярне рівняння. Реакції обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
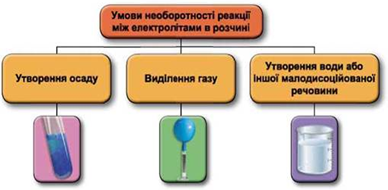
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Барій нітрат (В), на відміну від аргентум(І) нітрату (Г), не реагує з калій хлоридом у водному розчині, оскільки всі речовини залишаються у формі йонів (рис. 2).
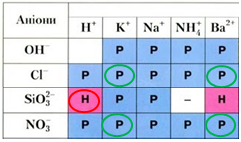
Рис. 2. Хлориди й нітрати Калію і Барію – розчинні речовини, а силікатна кислота нерозчинна
Унаслідок реакції між сульфатною кислотою і натрій силікатом (А) утворюється нерозчинна силікатна кислота, а в реакції з натрій карбонатом виділяється карбон(IV) оксид (Б).
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
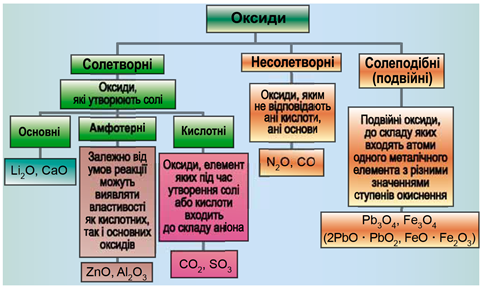
Рис. 1. Класифікація оксидів
Несолетворні оксиди не реагують із водою, кислотами, лугами. Представниками несолетворних оксидів є карбон(ІІ) оксид, нітроген(ІІ) оксид, нітроген(І) оксид.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку вміння застосовувати знання про хімічний склад, будову й загальні властивості лугів для прогнозування властивостей представників цієї групи неорганічних сполук.
Калій гідроксид – добре розчинна у воді речовина йонної будови, сильний електроліт, у водному розчині дисоціює з утворенням гідроксид-аніонів, які зумовлюють зміну забарвлення фенолфталеїну на малиновий, утворюється внаслідок взаємодії металу з водою:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Кислоти. Хлоридна кислота.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості хлоридної кислоти.
A
Б
B
Г
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Основні класи неорганічних сполук. Солі. Окисно-відновні реакції.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, окисно-відновна реакція, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин і розрізняти окисно-відновні реакції.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
У сполуках із неметалічними елементами Гідроген має ступінь окиснення +1, ступінь окиснення Оксигену зазвичай дорівнює -2.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів із меншою електронегативністю до атомів із більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
А
Б
В
Г
Зміна ступенів окиснення атомів хімічних елементів відбувається лише під час розкладання натрій нітрату.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Амфотерність.
Завдання скеровано на перевірку розуміння суті амфотерності.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості. З кислотами цинк гідроксид
Цинкати – солі слабкої кислоти, тому під дією сильних кислот руйнуються:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Якісні реакції на деякі йони. Забарвлення полум’я катіонами деяких металічних елементів. Якісна реакція на карбонат-аніони.
Завдання скеровано на перевірку вміння застосовувати знання якісних реакцій на катіони й аніони для ідентифікування речовин.
Якісні реакції – це хімічні реакції, за допомогою яких можна визначити, чим одна речовина відрізняється від іншої за елементним складом. Вони відбуваються між аналізованою речовиною та реагентом.
Пірохімічний аналіз (від грец. πυρо́ς - вогонь) – метод виявлення деяких хімічних елементів (наприклад, у мінералах) за різним забарвленням полум’я. Якщо внести розчин леткої солі (хлориду, карбонату, нітрату) у полум’я, воно набуде певного забарвлення (рис. 1).
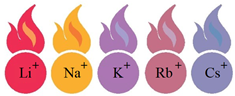
Рис. 1. Забарвлення полум’я катіонами лужних елементів
Забарвлення полум’я катіонами в складі досліджуваної солі дає змогу дійти висновку, що це сіль Натрію.
Газ виділиться внаслідок дії хлоридної кислоти на натрій гідрогенкарбонат:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальні відомості про металічні елементи й метали.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій солей у водних розчинах із металами.
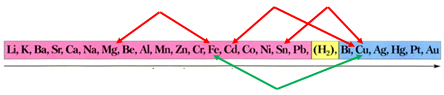
Активність металів зменшується
Порівнявши положення металів у ряду активності, можна дійти висновку, що залізо витісняє із солі мідь, оскільки розташоване лівіше від нього:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Твердість води і способи її усунення.
Завдання скеровано на перевірку розуміння причин твердості води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Найважливіші йони, які зумовлюють твердість води
| Катіони | Аніони |
|
|
|
Унаслідок кип’ятіння твердої води розчинні гідрогенкарбонати Кальцію і Магнію перетворюються на нерозчинні карбонати, які осідають на стінках чайника.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальні відомості про металічні елементи й метали. Алюміній, сполуки Алюмінію.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію, сполук Алюмінію.
I Алюміній належить до p-елементів, в його атомі заповнюється електронами p-підрівень:
II Алюміній гідроксид за нагрівання розкладається:
III У йона
IV Для добування водню в лабораторії можна використати алюміній і хлоридну кислоту:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Залізо. Сполуки Феруму.
Завдання скеровано на перевірку знання хімічних властивостей заліза й уміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
| A |
|
| Б |
|
| B |
|
| Г |
реакція не є окисно-відновною |
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Гідроген хлорид.
Завдання скеровано на перевірку вміння застосовувати знання про способи добування гідроген хлориду для аналізу результатів експерименту.
Дією концентрованої сульфатної кислоти на кристалічний натрій хлорид за нагрівання добувають гідроген хлорид. Цей газ добре розчиняється у воді, тому його збирають у пробірку з водою, унаслідок розчинення цього газу утворюється хлоридна кислота.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисники й відновники.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин, прогнозувати окисні й відновні властивості речовин.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
У карбонат- і нітрат-аніонах атоми Карбону й Нітрогену перебувають у своїх максимальних ступенях окиснення (+4 і +5 відповідно). Тому вони не можуть бути відновниками.
Натомість у сульфіт-аніоні атом Сульфуру перебуває в ступені окиснення +4, тобто може як приймати, так і віддавати електрони, а в сульфід-аніоні ступінь окиснення атома Сульфуру мінімальний (–2), тому він не може приймати електрони, а здатен лише віддавати їх.
Тобто відновні властивості здатні виявляти лише сульфіт- і сульфід-аніони.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Фосфор(V) оксид.
Завдання скеровано на перевірку знання властивостей фосфор(V) оксиду.
Кислотний фосфор(V) оксид реагує не лише з водою (на цій реакції ґрунтується застосування фосфор(V) оксиду як осушувача), а й з амоніаком, тому його не можна використовувати для видалення домішок водяної пари із цього газу. З рештою газів – азотом, киснем, карбон(ІV) оксидом – він не реагує.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин, прогнозувати окисні й відновні властивості речовин.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура алкінів.
Завдання скеровано на перевірку вміння називати алкени за систематичною номенклатурою.
Зі структурної формули, що містить подвійний зв’язок, зрозуміло, що йдеться про назву алкену розгалуженої будови.
Називати алкени за систематичною номенклатурою потрібно за алгоритмом, наведеним на схемі (рис. 1).

Рис. 1. Алгоритм побудови назв алкенів й алкінів за систематичною номенклатурою
Зверніть увагу: положення потрійного зв’язку й замісників позначають найменшими числами, але перевагу у виборі початку нумерації віддають потрійному зв’язку (рис. 2).
Цифрою 4 позначено замісник метил біля четвертого атома Карбону. Корінь гекс- указує на шість атомів Карбону в головному ланцюгу. Фрагмент назви -1-ин означає положення потрійного зв’язку після першого атома Карбону.
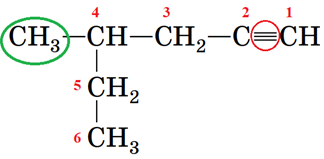
Рис. 2. 4-Метилгекс-1-ин
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкани. Нафта. Детонаційна стійкість.
Завдання скеровано на перевірку розуміння залежності детонаційної стійкості алканів від будови їхніх молекул, суті фракційної перегонки нафти.
Детонаційна стійкість характеризує здатність вуглеводнів протистояти самозайманню за стискання. Зі збільшенням розгалуженості карбонового ланцюга підвищується детонаційна стійкість алканів.
За стандарт у шкалі детонаційної стійкості вибрано гептан нерозгалуженої будови й 2,2,4-триметилпентан – один з ізомерів октану. Суміш пари гептану з повітрям унаслідок сильного стиснення легко детонує, тож якість гептану як палива прийнято за нуль. Унаслідок розгалуженості карбонового ланцюга ізооктан стійкий до детонації, тому його якість як палива узято за 100.
Перегонка нафти – спосіб її переробки, що ґрунтується на відмінності в температурах кипіння складників цієї суміші.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Хімічні властивості алкенів. Типи хімічних реакцій органічних речовин.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості алкенів і класифікувати хімічні реакції за участі органічних сполук.
Каталітичне гідрування пропену належить до реакцій приєднання – до молекули пропену приєднується молекула водню за місцем подвійного зв’язку:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкени й алкіни.
Завдання скеровано на перевірку вміння порівнювати властивості представників алкенів й алкінів.
A як етен, так і етин за нормальних умов є газами
Б молекули обох вуглеводнів містять кратні зв’язки й вступають у реакції приєднання, вони є ненасиченими
B як етен, так і етин знебарвлюють водний розчин калій перманганату унаслідок окиснення ним
Г етин на відміну від етену реагує з амоніачним розчином аргентум(І) оксиду
Зв’язок
Такі сполуки виявляють слабкі кислотні властивості й здатні вступати в реакції заміщення, зокрема заміщувати атом Гідрогену на атом металічного елемента, наприклад,
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Арени. Типи хімічних реакцій за участі органічних речовин.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за участі аренів.
Галогенування бензену за типом приєднання відбувається під дією світла (рівняння реакції 1).
Галогенування толуену за типом заміщення відбувається під дією світла: (рівняння реакції 2).
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Фенол.
Завдання скеровано на перевірку знання властивостей фенолу.
A у фенолі гідроксигрупа сполучена безпосередньо з вуглеводневим замісником фенілом, тому не належить до спиртів
Б відновленням нітробензену добувають анілін
B фенол є слабшою за карбонатну кислотою, тому не реагує із натрій гідрогенкарбонатом у водному розчині
Г унаслідок збільшення полярності зв’язку
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Повне окиснення органічних сполук.
Завдання скеровано на перевірку розуміння суті повного окиснення органічних речовин, уміння визначати їхній склад за продуктами повного окиснення на основі закону збереження маси речовин під час хімічних реакцій.
У правій частині хімічного рівняння дев’ять атомів Оксигену – шість у трьох молекулах карбон(ІV) оксиду й три – у трьох молекулах води.
У лівій частині хімічного рівняння вісім атомів Оксигену у чотирьох молекулах кисню.
Тобто в молекулі речовини X один атом Оксигену. Цю умову задовольняє речовина B.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Спирти. Карбонові кислоти. Естери.
Завдання скеровано на перевірку вміння застосовувати знання про суть реакції гідролізу естерів для визначення її продуктів за будовою молекули естеру.
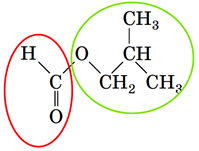
|
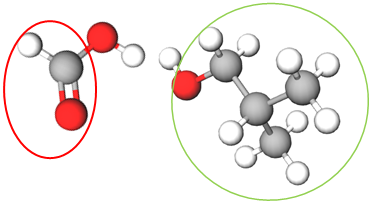
|
|
| Естер – продукт реакції між 2-метилпропан-1-олом і метановою кислотою |
Метанова кислота | 2-Метилпропан-1-ол |
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи.
Завдання скеровано на перевірку знання властивостей вуглеводів.
Гліцерол є триатомним спиртом, глюкоза – альдегідоспиртом.
A целюлоза не розчиняється у воді
Б продукт повного гідролізу крохмалю – глюкоза
B у глюкози й фруктози однакова молекулярна формула
Г крохмаль під дією водно-спиртового розчину йоду набуває синього кольору
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки.
Завдання скеровано на перевірку знання кольорових реакцій білків.
Ксантопротеїнову реакцію проводять для виявлення білків, молекули яких містять залишки ароматичних амінокислот. цю умову задовольняє амінокислота, структурна формула якої
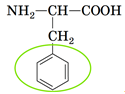
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Ізомерія. Гомологія.
Завдання скеровано на перевірку вміння застосовувати знання основних понять органічної хімії для розпізнавання ізомерів і гомологів, порівняння молекулярних і найпростіших формул речовин, їхніх хімічних властивостей.
1 формулі І не можуть відповідати два просторові ізомери, бо цис-, транс-ізомерія можлива в тому разі, якщо біля атомів Карбону, сполучених подвійним зв’язком, є різні замісники
2 речовини І і ІІ є ненасиченими вуглеводнями – алкенами
3 речовини І і ІІІ містять подвійні зв’язки і вступають в реакцію полімеризації
4 бензен (речовина 4) стійкий до окиснення, а пропен (речовина 1) легко окиснюється
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин і складних йонів, визначати кількість відданих або прийнятих під час окисно-відновних реакцій перетворень.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
| 1 | Б | |
| 2 | Д | |
| 3 | B | |
| 4 | A |
Відповідь: 1Б, 2Д, 3В, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння застосовувати знання про хімічні властивості неорганічних й органічних речовин для прогнозування продуктів хімічних реакцій.
| 1 | сполучення | продукт – одна складна речовина | A |
| 2 | заміщення | продукти й реагенти – проста й складна речовини | Г |
| 3 | розкладання | реагент – одна складна речовина | Д |
| 4 | обмін | продукти й реагенти – дві складні речовини | Б |
Відповідь: 1А, 2Г, 3Д, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Класи органічних сполук.
Завдання скеровано на перевірку вміння класифікувати органічні речовини за характеристичними групами в їхніх молекулах.
| Клас органічних сполук | Характеристичн(а/і) груп(а/и) в молекулі | ||
| 1 | альдегіди | альдегідна | Д |
| 2 | спирти | гідроксильна | Г |
| 3 | естери | естерна | А |
| 4 | етери | етерна | В |
Відповідь: 1Д, 2Г, 3А, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Типи хімічних реакцій в органічній хімії.
Завдання скеровано на перевірку вміння класифікувати реакції за участю органічних речовин.
| Хімічна реакція | Тип хімічної реакції | ||
| 1 | відщеплення води від етанолу | відщеплення | Г |
| 2 | приєднання водню до пропену | приєднання | Б |
| 3 | заміщення атома Гідрогену на атом Хлору в молекулі бензену | заміщення | А |
| 4 | ізомеризація пентану в 2-метилбутан | ізомеризація | В |
Відповідь: 1Г, 2Б, 3А, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Карбонові кислоти.
Завдання скеровано на перевірку вміння класифікувати карбонові кислоти за природою вуглеводневого замісника й основністю.
| 1 | одноосновна ароматична містить одну карбоксильну групу, сполучену з бензеновим кільцем | Г |
| 2 | одноосновна насичена містить одну карбоксильну групу, сполучену з фрагментом насиченого вуглеводню | B |
| 3 | двохосновна ароматична містить дві карбоксильні групи, сполучені з бензеновим кільцем | Д |
| 4 | двохосновна насичена містить дві карбоксильні групи, сполучені з фрагментом насиченого вуглеводню | Б |
Відповідь: 1Г, 2В, 3Д, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Хімічні властивості органічних сполук.
Завдання скеровано на перевірку вміння прогнозувати продукти хімічних реакцій за участі органічних речовин.
| 1 | гідратацією етену добувають етанол | Д |
| 2 | гідратацією етину добувають етаналь | Б |
| 3 | ізомеризацією бутану добувають 2-метилпропан | Г |
| 4 | повним окисненням бутану добувають карбон(ІV) оксид і воду | А |
Відповідь: 1Д, 2Б, 3Г, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Кількість речовини.
Завдання скеровано на перевірку розуміння змісту поняття «кількість речовини».
Кількість речовини дорівнює частці від ділення маси речовини на її молярну масу. Оскільки маси порцій речовин однакові, то що більша молярна маса речовини, тим менша її кількість у порції.
| А | 1 | |
| Б | 3 | |
| В | 2 | |
| 4 | 4 |
Відповідь: 1А, 2В, 3Б, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Фізичні властивості карбонових кислот.
Завдання скеровано на перевірку вміння аналізувати будову молекул карбонових кислот і прогнозувати їхні фізичні властивості.
Найдовша й найменш розгалужена молекула гексанової кислоти, температура кипіння якої з поміж наведених кислот найвища. У решти трьох кислот по п’ять атомів Карбону в молекулах. Найменше розгалужена з-поміж них молекула пентанової кислоти, найбільше – 2,2-диметилпропанової.
Відповідь: 1Г, 2В, 3Б, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу газу за його відносною густиною.
Дано:
Знайти:
Відповідь: 64.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати кількісний склад газової суміші за її масою й об’ємом.
Дано:
Знайти:
Відповідь: 20.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати масу (об’єм) розчину й розчинника; масу й масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 40.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння здійснювати обчислення за хімічними рівняннями.
Дано:
1. Знайти:
2. Знайти:
Відповідь: 1. 28. 2. 125.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати масу й молекулярну формулу речовини за її кількістю речовини і масами (об’ємами) продуктів її повного окиснення.
Дано:
1. Знайти:
2. Знайти:
Відповідь: 1. 8. 2. 15.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати масу продукту реакції за відомими масою реагенту й масовою часткою чистої речовини в ньому.
Дано:
Знайти:
Відповідь: 21.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою окисника – 3.
Відповідь: 3.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 70.
Знайшли помилку? Пишіть на




