ЗНО онлайн 2009 року з хімії – основна сесія
Тестові завдання основної сесії ЗНО 2009 року з хімії
ТЕМА: Техніка хімічного експерименту. Правила безпечного використання лабораторного обладнання.
Завдання скеровано на перевірку знання техніки хімічного експерименту, вміння правильно поводитися з лабораторним обладнанням.
Правильне виконання лабораторної операції зображено на рисунку А. Цій інформації, поданій у графічній формі, відповідає такий словесний опис: «Уважно читайте етикетку на посудині з речовиною, яку берете для досліду. Відкривши посудину, не кладіть пробку на лабораторний стіл боком, а ставте вертикально, догори поверхнею, яка контактувала з умістом посудини. Наливаючи рідину, посудину з реактивом беріть так, щоб етикетку було спрямовано в бік долоні. Знімайте краплю з шийки посудини, бо рідина стікатиме по склу, псуватиме етикетку й може пошкодити шкіру рук».
На решті фрагментів зображено виконання лабораторних операцій з порушенням техніки безпеки, адже НЕ МОЖНА:
- зазирати в посудину з рідиною, що кипить (Б);
- закривати пальцем отвір пробірки з речовиною і струшувати її (В);
- нюхати газ, схилившись над отвором посудини, глибоко вдихаючи (Г).
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Початкові хімічні поняття. Класифікація речовин за якісним і кількісним складом. Прості та складні речовини.
Завдання скеровано на перевірку вміння розпізнавати складні речовини.
Прості речовини утворені одним хімічним елементом, а складні – кількома. Умову завдання задовольняє сульфур(VI) оксид
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електролітична дисоціація. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння перетворювати скорочені йонні рівняння на молекулярні.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умову завдання задовольняє такий варіант відповіді:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Нукліди. Ізотопи.
Завдання скеровано на перевірку розуміння ізотопії.
Ізотопи – різновиди атомів одного хімічного елемента з різною кількістю нейтронів. Різновид атомів з певною кількістю нейтронів у ядрі називають нуклідом.
Ізотопи – це нукліди одного хімічного елемента.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Валентні електрони.
Завдання скеровано на перевірку розуміння поняття «валентні електрони» й уміння визначати валентні можливості атомів.
Валентний електрон – електрон, що може утворювати хімічні зв’язки, в атомі, а отже, визначає поведінку атома в хімічних реакціях.
Електронна конфігурація атома Сульфуру
Електронна конфігурація атома Хрому
Сульфур і Хром – елементи різних періодів, у їхніх атомах різна кількість енергетичних рівнів і валентних орбіталей.
У бінарних сполуках із Гідрогеном Сульфур(ІІ) і Хром(ІІ) мають різні ступені окиснення:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Енергетичні рівні й підрівні.
Завдання скеровано на перевірку вміння визначати кількість енергетичних рівнів в електронній оболонці атомів.
Номер періоду, у якому міститься хімічний елемент, збігається з кількістю енергетичних рівнів у його електронній оболонці.
Тобто умову завдання задовольняє пара хімічних елементів, що належать до одного періоду. Їхні протонні числа –
| Хімічний елемент | |||
| Протонне число | Символ | Номер періоду | Кількість енергетичних рівнів в атомі |
| 7 | 2 | ||
| 8 | 2 | ||
| 15 | 3 | ||
| 16 | 3 | ||
| 33 | 4 | ||
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічний зв’язок. Йонний зв’язок.
Завдання скеровано на перевірку вміння визначати тип хімічного зв’язку в сполуці за її формулою.
Умову завдання задовольняє варіант відповіді натрій флуорид. Натрій – типовий металічний елемент, Флуор – типовий неметалічний. Електрон із зовнішнього енергетичного рівня атома Натрію переходить на зовнішній енергетичний рівень атома Флуору. Утворюються катіон Натрію і флуорид-аніон (рис. 1).

Рис. 1. Утворення йонного зв’язку в натрій флуориді
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Амфотерність. Цинк гідроксид.
Завдання скеровано на перевірку розуміння суті амфотерності.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості. З кислотами цинк гідроксид
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Оксиди. Кислотні оксиди.
Завдання скеровано на перевірку вміння розпізнавати кислотні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
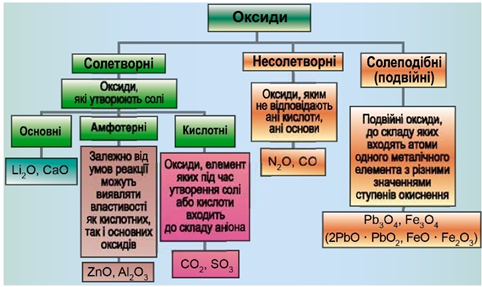
Рис. 1. Класифікація оксидів
Умову завдання задовольняє сульфур(IV) оксид, який реагує з водою з утворенням сульфітної кислоти:
Інший кислотний оксид – силіцій(IV) оксид
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Оксиди. Несолетворні оксиди.
Завдання скеровано на перевірку вміння розпізнавати несолетворні оксиди.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
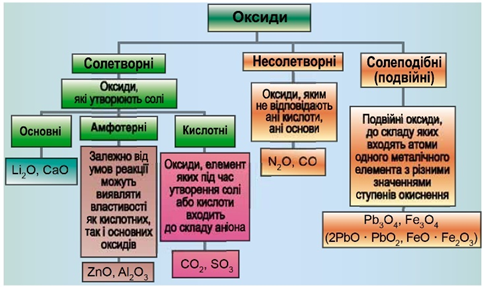
Рис. 1. Класифікація оксидів
Умову завдання задовольняє карбон(ІІ) оксид.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Солі. Класифікація солей. Кислі солі.
Завдання скеровано на перевірку вміння розпізнавати формули кислих солей.
Кисла сіль – продукт неповного заміщення атомів Гідрогену в молекулі кислоти атомами металічного елемента.
Умову завдання задовольняє речовина, формула якої
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Електронні формули. Основний і збуджений стани атома.
Завдання скеровано на перевірку вміння складати й аналізувати електронні формули атомів в основному й збудженому станах.
Графічний варіант електронної формули атома Силіцію в основному стані наведено на рисунку 1.
Рис. 1. Електронна формула атома Силіцію в основному стані
В атомі Силіцію в основному стані два неспарених p-електрони.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Характеристика хімічного елемента за його місцем у періодичній системі.
Завдання скеровано на перевірку вміння визначати формули найважливіших сполук хімічного елемента за його місцем у періодичній системі.
Елемент № 16 у періодичній системі – Сульфур – міститься в 6А (16) групі. В атомі цього елемента на зовнішньому енергетичному рівні шість електронів, тож його вищий ступінь окиснення
Формули його леткої сполуки з Гідрогеном, вищого оксиду й кислоти такі:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Швидкість хімічної реакції. Чинники, що впливають на швидкість хімічної реакції. Каталіз.
Завдання скеровано на перевірку вміння аналізувати чинники, що впливають на швидкість хімічної реакції.
У лабораторних умовах кисень добувають розкладанням деяких оксигеновмісних речовин, зокрема гідроген пероксиду:
Нагрівання і каталізатор пришвидшують цей процес.
Каталізатори – речовини, які пришвидшують хімічні реакції, але не входять до складу їхніх продуктів.
Щіпка манган(ІV) оксиду пришвидшує розкладання все нових і нових порцій гідроген пероксиду. Сам манган(ІV) оксид бере участь у реакції, однак унаслідок її залишається незмінним.
Тож реакція в другій пробірці відбуватиметься швидше, а тому саме в ній швидше займеться жеврійна скіпка.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Металічні елементи. Метали. Сполуки Феруму. Залізо.
Завдання скеровано на перевірку знання хімічних властивостей заліза й уміння прогнозувати перебіг реакцій за його участі.
Залізо в ряду активності металів розташоване лівіше від водню, міді й срібла та правіше від натрію, барію, магнію (рис. 1).

Рис. 1. Ряд активності металів
Тобто з-поміж запропонованих можливі такі реакції:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Електронні формули
Завдання скеровано на перевірку вміння складати електронні формули атомів і простих йонів.
Катіон
Електронні формули атома й катіона Феруму такі:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Ступінь окиснення.
Завдання скеровано на перевірку вміння складати електронні формули атомів і визначати ступені окиснення атомів хімічних елементів у сполуках.
Ступінь окиснення елемента – це чисельна величина електричного заряду, приписуваного атому в молекулі, якщо припустити, що електронні пари, які забезпечують зв’язок, повністю зміщені в бік більш електронегативних атомів.
В атомі Силіцію – елемента IVА (14) групи – чотири електрони на зовнішньому енергетичному рівні. Завершення зовнішнього енергетичного рівня можливе внаслідок приєднання або втрати чотирьох електронів. Унаслідок чого атом Силіцію набуде ступеня окиснення –4 або +4 відповідно:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Металічні елементи. Ферум.
Завдання скеровано на перевірку знання хімічних властивостей заліза і сполук Феруму та вміння аналізувати з погляду окиснення-відновлення реакції за їхньої участі.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Залізо відновлює Хром із хром(ІІІ) оксиду:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Сульфур. Алотропія Сульфуру.
Завдання скеровано на перевірку розуміння алотропії та знання алотропних видозмін Сульфуру.
Алотропія Сульфуру зумовлена відмінностями в складі та будові утворених цим елементом простих речовин, здатних до взаємоперетворення. Кристалічна сірка – крихка речовина жовтого кольору, не розчиняється у воді. Сірка важча за воду, тому її кристали опускаються на дно посудини. Однак уміщений у посудину з водою порошок сірки спливає на поверхню. Це відбувається тому, що цей неметал водою не змочується. Сірка – діелектрик і від тертя сильно електризується та набуває від’ємного заряду.
Сірка утворена циклічними молекулами
Унаслідок підвищення температури руйнуються слабкі міжмолекулярні зв’язки в кристалах і вивільняються циклічні молекули
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними сполуками.
Умову завдання задовольняє карбон(IV) оксид:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи. Оксигеновмісні органічні сполуки. Жири.
Завдання скеровано на перевірку знання властивостей жирів і вуглеводів.
У разі отруєння нафтопродуктами не можна споживати тваринні жири й олії, оскільки нафтопродукти (вуглеводи) розчиняються в них і затримуються в організмі.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні поняття органічної хімії. Гомологія. Гомологічний ряд.
Завдання скеровано на перевірку розуміння суті гомології.
Речовини з однаковим якісним складом, подібні за будовою і хімічними властивостями, називають гомологами. За кількісним складом вони відрізняються один від одного на одну або декілька груп
Загальна формула вуглеводнів гомологічного ряду етену
До алкенів належить вуглеводень, формула якого
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Ізомерія. Ізомери.
Завдання скеровано на перевірку вміння визначати формули ізомерів.
Ізомери – речовини з однаковою молекулярною формулою, але різною будовою молекул.
Молекулярна формула гексану
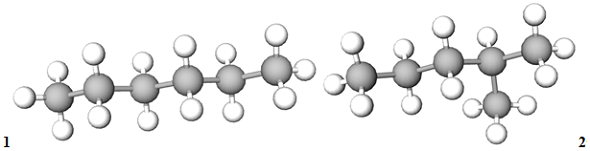
Рис. 1. Моделі молекул гексану (1) і 2-метилпентану (2)
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Номенклатура алкінів.
Завдання скеровано на перевірку вміння називати алкіни за систематичною номенклатурою.
Зі структурної формули, що містить потрійний зв’язок, зрозуміло, що йдеться про назву алкіну розгалуженої будови.
Називати алкіни за систематичною номенклатурою потрібно за алгоритмом, наведеним на схемі (рис. 1).

Рис. 1. Алгоритм побудови назв алкенів й алкінів за систематичною номенклатурою
Зверніть увагу: положення кратного зв’язку й замісників позначають найменшими числами, але перевагу у виборі початку нумерації віддають кратному зв’язку (рис. 2).
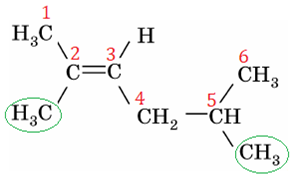
Рис. 2. Структурна формула 2,5-диметилгекс-2-ену
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Алкани. Хімічні властивості алканів.
Завдання скеровано на перевірку вміння аналізувати рівняння реакцій, що властиві алканам.
За умовою завдання
Рівняння реакції хлорування метану таке:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Багатоатомні спирти.
Завдання скеровано на перевірку вміння розпізнавати формули багатоатомних спиртів.
Залежно від кількості гідроксигруп спирти поділяють на одноатомні та багатоатомні.
Умову завдання задовольняє двохатомний спирт пропан-1,2-діол.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Альдегіди. Якісна реакція на альдегідну групу.
Завдання скеровано на перевірку знання якісної реакції на альдегідну групу.
Реактивом на альдегідну групу є амоніачний розчин аргентум(І) оксиду. У результаті реакції утворюється срібне дзеркало з відновленого срібла, альдегід окиснюється до карбонової кислоти:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Спирти. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між алкенами й спиртами.
Етен є продуктом дегідратації еанолу:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Естери.
Завдання скеровано на перевірку знання поширення оксигеновмісних органічних сполук у природі.
Запахи квітів здебільшого багатокомпонентні, духмяним їхнім складником є переважно естери.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Вуглеводи. Глюкоза.
Завдання скеровано на перевірку знання якісної реакції на багатоатомні спирти й альдегідну групу.
Глюкоза є альдегідоспиртом і без нагрівання реагує з купрум(ІІ) гідроксидом як багатоатомний спирт. Адже в її молекулі є п’ять гідроксильних груп біля сусідніх атомів Карбону. Так само з купрум(ІІ) гідроксидом реагує триатомний спирт гліцерол.
За нагрівання реакція глюкози з купрум(ІІ) гідроксидом відбувається за участі альдегідної групи: глюкоза окиснюється до глюконової кислоти, а купрум(ІІ) гідроксид відновлюється до купрум(І) гідроксиду. Ця речовина жовтого кольору за нагрівання розкладається на цегляно-червоний купрум(І) оксид і воду:
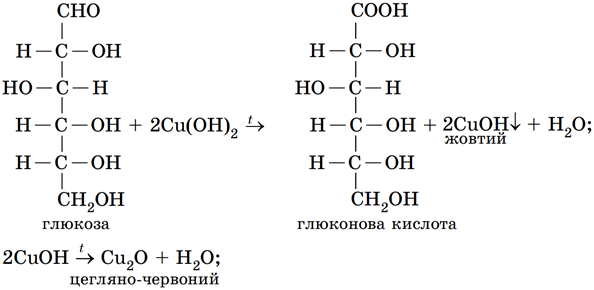
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Спирти.
Завдання скеровано на перевірку знання хімічних властивостей спиртів.
Спирти вступають у реакції з відщепленням гідроксильної групи, до яких, наприклад, належить реакція з гідроген хлоридом. У цій реакції виявляються слабкі основні властивості спиртів завдяки взаємодії протона кислоти з вільною електронною парою атома Оксигену.
У цій реакції спирти виявляють слабкі основні властивості внаслідок взаємодії протона кислоти з вільною електронною парою атома Оксигену:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Вуглеводи. Полісахариди.
Завдання скеровано на перевірку знання будови макромолекули крохмалю.
Полімерний ланцюг крохмалю утворюється з мономерних ланок – залишків α‑глюкози (рис. 1).
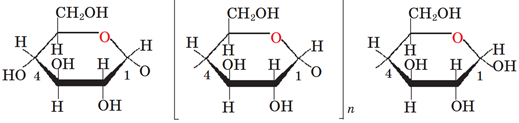
Рис. 1. Схематичне зображення будови молекули крохмалю
Кінцевим продуктом кислотного гідролізу крохмалю є α-глюкоза.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Аміни. Анілін.
Завдання скеровано на перевірку вміння класифікувати аміни.
Анілін (бензенамін) – найпростіший ароматичний амін, його хімічну формулу зображено на рисунку 1.
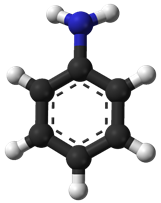
Рис. 1. Модель молекули аніліну
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Аміни. Визначення відносної молекулярної маси речовини за її відносною густиною.
Завдання скеровано на перевірку вміння визначати відносну молекулярну масу речовини за її відносною густиною.
Відносна густина газуватої речовини
Умову завдання задовольняє метиламін.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Білки. Кольорові реакції білків.
Завдання скеровано на перевірку знання кольорових реакцій білків.
Поява жовтого забарвлення в результаті реакції білка з концентрованою нітратною кислотою (ксантопротеїнова реакція) свідчить про наявність бензенових кілець у структурі білка.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електролітична дисоціація. Рівняння електролітичної дисоціації.
Завдання скеровано на перевірку вміння прогнозувати продукти електролітичної дисоціації.
Речовини, водні розчини яких проводять електричний струм, називають електролітами.
Електролітична дисоціація у водних розчинах – це повний або частковий розпад електроліту на йони під впливом полярних молекул води.
Кислотами називають електроліти, унаслідок дисоціації яких не утворюються жодні інші катіони, крім гідратованих йонів Гідрогену.
Луги (розчинні основи) – це електроліти, які у водному розчині дисоціюють з утворенням гідратованих гідроксид-аніонів. Жодних інших негативних йонів під час цього процесу не утворюється.
Кислі солі – це електроліти, які у водних розчинах дисоціюють на будь-які гідратовані катіони й катіони Гідрогену
Основні солі – це електроліти, які у водних розчинах дисоціюють на будь-які гідратовані катіони крім катіонів Гідрогену
| Клас неорганічних сполук | Рівняння електролітичної дисоціації | ||
| 1 | кисла сіль | B | |
| 2 | кислота | Б | |
| 3 | основа | Г | |
| 4 | основна сіль | A |
Відповідь: 1В; 2Б; 3Г; 4А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди, основи, кислоти, солі.
Завдання скеровано на перевірку вміння розпізнавати формули оксидів, основ, кислот, солей.
| Клас неорганічних сполук | Визначення | Речовина | |||
| Формула | Назва | ||||
| 1 | кислоти | Складні речовини, утворені атомами Гідрогену, сполученими з кислотними залишками. Валентність кислотного залишку дорівнює кількості атомів Гідрогену в молекулі кислоти | сульфатна кислота | B | |
| 2 | оксиди | Складні речовини, утворені двома елементами, одним із яких є Оксиген у ступені окиснення –2 | сульфур(VI) оксид | Д | |
| 3 | основи | Складні речовини, утворені катіонами металічних елементів й аніонами гідроксильних груп. Кількість гідроксильних груп у формулі основи дорівнює ступеню окиснення металічного елемента в ній | кальцій гідроксид | A | |
| 4 | солі | Складні речовини, йонні сполуки. Середні солі утворені катіонами металічних елементів або/та амонію й аніонами кислотних залишків | кальцій сульфат | Б | |
Відповідь: 1В; 2Д; 3А; 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Солі.
Завдання скеровано на перевірку вміння розпізнавати формули солей Кальцію – головних складників деяких мінералів.
| 1 | Доломіт | Б | |
| 2 | Гіпс | Д | |
| 3 | Кальцит | A | |
| 4 | Фосфорит | Г |
Відповідь: 1Б; 2Д; 3А; 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи. Оксигеновмісні органічні сполуки. Застосування органічних речовин.
Завдання скеровано на перевірку розуміння зумовленості застосування органічних речовин їхніми властивостями.
Органічні речовини широко використовують у різних галузях суспільного господарства, найпоширеніші сфери застосування деяких із них наведено в таблиці.
| Речовина | |||
| Назва | Галузь використання | ||
| 1 | бензен | розчинник | Д |
| 2 | гліцерол | парфумерія і фармація | Г |
| 3 | метан | пальне в побуті та промисловості | В |
| 4 | фенол | виробництво пластмас, зокрема фенолформальдегідних смол | А |
Відповідь: 1Д; 2Г; 3В; 4A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Характеристичні групи.
Завдання скеровано на перевірку вміння класифікувати оксигеновмісні органічні сполуки за характеристичними групами в їхніх молекулах.
Характеристична група – це атом або група атомів, що визначає природу речовини, тобто її належність до певного класу органічних сполук, та зумовлює її найхарактерніші хімічні властивості (рис. 1).
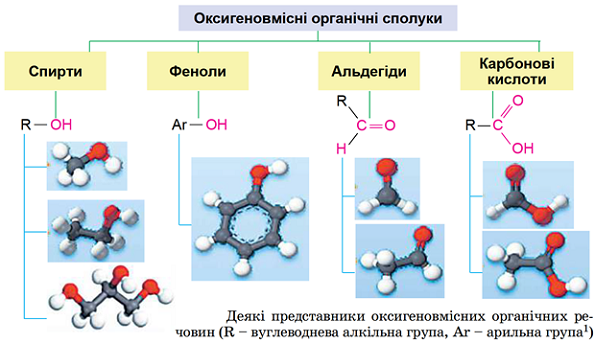
Рис. 1. Деякі класи органічних сполук та їхні представники
| Характеристична група спиртів – гідроксильна |  |
| Альдегіди – аліфатичні та ароматичні органічні сполуки, що містять альдегідну групу |
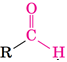 |
| Молекули одноосновних карбонових кислот утворені вуглеводневим замісником |
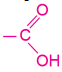 |
| Загальна структурна формула естерів | 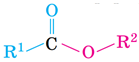 |
| Речовина | ||||
| Модель молекули | Назва | Клас органічних сполук | ||
| 1 | 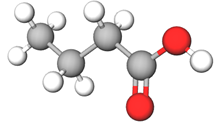 |
Бутанова кислота | Карбонова кислота | Б |
| 2 | 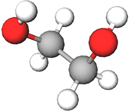 |
Етан-1,2-диол | Двохатомний спирт | Д |
| 3 | 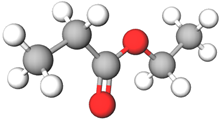 |
Етилпропаноат | Естер | Г |
| 4 | 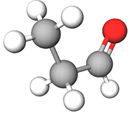 |
Пропаналь | Альдегід | А |
Відповідь: 1Б; 2Д; 3Г; 4А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічні рівняння.
Завдання скеровано на перевірку вміння складати й аналізувати хімічні рівняння на основі закону збереження маси речовин під час хімічних реакцій.
| Хімічне рівняння | Сума коефіцієнтів | |
| B | ||
| Б | ||
| A | ||
| Г |
Відповідь: В Б А Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Відносна густина газу.
Завдання скеровано на перевірку розуміння поняття відносної густини газу.
Відносна густина
Тобто густина газу то більша, що більша його молекулярна маса.
| Газ | |||
| Назва | Хімічна формула | Відносна молекулярна маса | |
| Карбон(II) оксид | 28 | A | |
| Нітроген(II) оксид | 30 | B | |
| Карбон(IV) оксид | 44 | Б | |
| Нітроген(IV) оксид | 46 | Г | |
Відповідь: А В Б Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Генетичні зв’язки між основними класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними сполуками різних класів.
У завданні йдеться про такі перетворення:
Відповідь: Б А В Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Розчини. Електролітична дисоціація.
Завдання скеровано на перевірку розуміння електролітичної дисоціації багатоосновних сильних кислот у розведених розчинах.
Оскільки розчин розведений, найбільше в ньому молекул води.
Сульфатна кислота як сильний електроліт дисоціює практично повністю, тому кількість сульфат-іонів – на другому місці.
На третьому місці – гідрогенсульфат-аніони – продукти неповної дисоціації сульфатної кислоти.
Сульфатна кислота – сильний електроліт, тому її молекул у розчині найменше.
Відповідь: Б Г А В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Будова атома. Енергетичні рівні.
Завдання скеровано на перевірку вміння визначати кількість електронів на зовнішньому енергетичному рівні атома за місцем хімічного елемента в періодичній системі.
В атомах елементів головних підгруп кількість електронів на зовнішньому енергетичному рівні збігається з номером групи в короткоперіодній формі періодичної системи.
| Назва хімічного елемента | Номер групи | Кількість електронів на зовнішньому енергетичному рівні атома | |
| Натрій | ІА | 1 | B |
| Кальцій | ІІА | 2 | Б |
| Алюміній | ІІІА | 3 | A |
| Силіцій | IVА | 4 | Г |
Відповідь: В Б А Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Генетичні зв’язки між основними класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними сполуками різних класів.
У завданні йдеться про такі перетворення:
Відповідь: Г В Б А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Генетичні зв’язки між основними класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними сполуками різних класів.
У завданні йдеться про такі перетворення:
Відповідь: Б Г А В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Генетичні зв’язки між основними класами неорганічних сполук. Неорганічна хімія. Сполуки Нітрогену. Добрива.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними сполуками різних класів.
У завданні йдеться про такі перетворення:
Відповідь: Б В Г А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між основними класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними сполуками різних класів.
У завданні йдеться про такі перетворення:
Відповідь: А Б Г В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між основними класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними сполуками різних класів.
У завданні йдеться про такі перетворення:
Відповідь: Г Б В А.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями маси продукту за масою реагенту.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням масу продукту за масою реагенту.
Дано:
Знайти:
Відповідь: 128.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Визначення формули речовини за даними щодо будови її атома.
Завдання скеровано на перевірку вміння встановлювати зв’язок між місцем елемента в періодичній системі, будовою його атома, формулами найважливіших сполук хімічного елемента та аналізувати їх.
Дано:
Знайти:
Магній – елемент ІІА групи періодичної системи хімічних елементів, у його атомі на зовнішньому енергетичному рівні два електрони. Відповідно в атомі шуканого елемента на зовнішньому енергетичному рівні шість електронів, тож це елемент VІА групи третього періоду.
Умову завдання задовольняє Сульфур, формула його вищого оксиду –
Відповідь: 4.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічною формулою молярної маси речовини.
Завдання скеровано на перевірку вміння обчислювати за хімічною формулою кристалогідрату його молярної маси.
Дано:
Знайти:
Відповідь: 278.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розчини. Масова частка й маса розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку й масу розчиненої речовини.
Дано:
Знайти:
Відповідь: 200.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічним рівнянням маси продукту реакції за відомим об’ємом газуватого реагенту.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням масу продукту реакції за відомим об’ємом газуватого реагенту.
Дано:
Знайти:
Відповідь: 64.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічним рівнянням маси продукту реакції за кількісними даними щодо реагентів.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням масу продукту реакції за кількісними даними щодо реагентів.
Дано:
Знайти:
Відповідь: 10.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічним рівнянням об’єму продукту реакції за кількістю речовини реагенту.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням об’єм продукту реакції за кількістю речовини реагенту.
Дано:
Знайти:
Відповідь: 112.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічним рівнянням маси продукту реакції за об’ємом газуватого реагенту.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням масу продукту реакції за об’ємом газуватого реагенту.
Дано:
Знайти:
Відповідь: 96.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Визначення молекулярної формули речовини за масовими частками хімічних елементів у ній.
Завдання скеровано на перевірку вміння визначати найпростішу формулу речовини за масовими частками хімічних елементів у ній.
Дано:
Знайти:
Відповідь: 6.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Визначення молекулярної формули речовини за кількісними даними щодо продуктів її згоряння.
Завдання скеровано на перевірку вміння визначати молекулярну формулу речовини за кількісними даними щодо продуктів її згоряння.
Дано:
Знайти:
Відповідь: 9.
Знайшли помилку? Пишіть на




