ЗНО онлайн 2010 року з хімії – додаткова сесія
Тестові завдання додаткової сесії ЗНО 2010 року з хімії
ТЕМА: Будова атома. Протонне число.
Завдання скеровано на перевірку розуміння фізичного змісту порядкового номера хімічного елемента в періодичній системі.
Порядковий номер хімічного елемента в періодичній системі дорівнює його протонному числу й, відповідно, заряду ядра атома. У цьому полягає фізичний зміст порядкового номера хімічного елемента в періодичній системі.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів хімічних елементів.
Формула вищого оксиду
Умову завдання задовольняє електронна формула атома Нітрогену
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів.
Завдання скеровано на перевірку розуміння фізичного змісту порядкового номера хімічного елемента в періодичній системі.
Умову завдання задовольняє пара елементів
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Нуклонне число. Кількість нейтронів у нукліді.
Завдання скеровано на перевірку вміння визначати склад атомних ядер.
| Нуклідний символ | Протонне число, зарядове число, порядковий номер, |
Масове або нуклонне число, |
Нейтронне число, |
| 13 | 27 | 14 |
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічний зв’язок. Ковалентний зв’язок.
Завдання скеровано на перевірку розуміння природи ковалентного зв’язку.
Хімічним зв’язком називають сили, які утримують частинки (атоми, йони) в молекулах або кристалах.
Під час утворення молекул у хімічних реакціях атоми хімічних елементів набувають стійкої зовнішньої оболонки з вісьмох електронів.
Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул.
Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільної електронної пари розподілений між ними порівну. Такий зв’язок називають ковалентним неполярним.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари.
Зі збільшенням протонного числа електронегативність хімічних елементів зростає в періодах і зменшується в підгрупах.
Ковалентний зв’язок між атомами неметалічних елементів, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічний зв’язок. Ковалентний зв’язок.
Завдання скеровано на перевірку розуміння природи ковалентного зв’язку.
Хімічним зв’язком називають сили, які утримують частинки (атоми, йони) в молекулах або кристалах.
Під час утворення молекул у хімічних реакціях атоми хімічних елементів набувають стійкої зовнішньої оболонки з вісьмох електронів.
Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул.
Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільної електронної пари розподілений між ними порівну. Такий зв’язок називають ковалентним неполярним.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари.
Зі збільшенням протонного числа електронегативність хімічних елементів зростає в періодах і зменшується в підгрупах.
Ковалентний зв’язок між атомами неметалічних елементів, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Умову завдання задовольняє пара речовин, формули яких
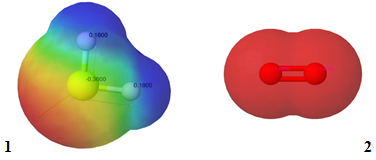
Рис. 1. Розподіл електронної густини в молекулах гідроген сульфіду (1) і кисню (2)
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Будова атома. Протонне число.
Завдання скеровано на перевірку розуміння фізичного змісту порядкового номера хімічного елемента в періодичній системі.
Порядковий номер хімічного елемента в періодичній системі дорівнює його протонному числу й, відповідно, заряду ядра атома. У цьому полягає фізичний зміст порядкового номера хімічного елемента в періодичній системі.
У завданні йдеться про бінарну сполуку Магнію
Умову завдання задовольняє магній оксид
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння природи хімічного зв’язку.
Хімічним зв’язком називають сили, які утримують частинки (атоми, йони) в молекулах або кристалах.
Під час утворення молекул у хімічних реакціях атоми хімічних елементів набувають стійкої зовнішньої оболонки з вісьмох електронів.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Будова атома. Протонне число.
Завдання скеровано на перевірку розуміння фізичного змісту порядкового номера хімічного елемента в періодичній системі.
Порядковий номер хімічного елемента в періодичній системі дорівнює його протонному числу й, відповідно, заряду ядра атома. У цьому полягає фізичний зміст порядкового номера хімічного елемента в періодичній системі.
Порядкові номери Натрію і Калію в періодичній системі й, відповідно, їхні протонні числа становлять
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Алюміній. Окисно-відновні реакції.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію і вміння аналізувати реакції за його участі з погляду окиснення-відновлення.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Алюмінію менша за електронегативність Сульфуру. Тож алюміній виявлятиме відновні властивості в реакції із сіркою:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Ступінь окиснення. Хлор.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію і вміння аналізувати реакції за його участі з погляду окиснення-відновлення.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Cтупінь окиснення Хлору в калій хлораті становить
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Фізичний зміст номера періоду та номера групи. Неорганічна хімія. Хлор. Гідроген хлорид.
Завдання скеровано на перевірку вміння визначати хімічний елемент за його місцем у періоді й групі та знання хімічних властивостей гідроген хлориду.
Елемент третього періоду, в атомі якого міститься сім електронів, – Хлор. Водний розчин його леткої сполуки з Гідрогеном – хлоридна кислота. Під дією хлоридної кислоти універсальний індикаторний папірець набуде червоного кольору.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Алюміній. Нітратна кислота.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію і нітратної кислоти.
Концентровану нітратну кислоту можна зберігати та транспортувати в цистернах, виготовлених з алюмінію, тому що цей метал під дією сильного окисника, яким є концентрована нітратна кислота, укривається щільним шаром алюміній оксиду.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Сполуки Нітрогену. Амоніак.
Завдання скеровано на перевірку знання хімічних властивостей амоніаку.
Каталітичне окиснення амоніаку описують таким хімічним рівнянням:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Арени. Бензен.
Завдання скеровано на перевірку знання хімічних властивостей бензену.
Хімічні властивості бензену зумовлені його хімічною будовою. Через особливості будови молекули бензен є досить малоактивною речовиною, однак за певних умов бере участь як у реакціях приєднання, подібно до ненасичених вуглеводнів, так і в реакціях заміщення, подібно до алканів.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Сполуки Силіцію. Силіцій(IV) оксид.
Завдання скеровано на перевірку знання поширеності в природі, будови й застосування силіцій(IV) оксиду.
Умову завдання задовольняє силіцій(IV) оксид, молярна маса якого становить
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Фосфор. Алотропні видозміни Фосфору.
Завдання скеровано на перевірку розуміння зумовленості властивостей речовин їхньою будовою.
Кристалічні ґратки - модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: атомні, молекулярні, йонні.
Молекулярні кристалічні ґратки побудовані з молекул речовини. Зазвичай у таких речовин низькі температури плавлення й кипіння, адже молекули слабко зв’язані між собою.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичний зв’язок між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичний зв’язок між органічними сполуками.
Умову завдання задовольняє хлороетан:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Гомологія. Гомологічний ряд алканів.
Завдання скеровано на перевірку розуміння суті гомології та знання загальної формули алканів.
З-поміж розмаїття органічних сполук можна виокремити речовини з однаковим якісним складом, подібні за будовою та хімічними властивостями. Такі речовини називають гомологами. За кількісним складом вони відрізняються один від одного на одну або декілька груп
Гомологи, розташовані за зростанням їхньої молекулярної маси, утворюють гомологічний ряд. Формула будь-якого наступного гомолога може бути отримана додаванням гомологічної різниці до формули попереднього члена гомологічного ряду.
Загальна формула вуглеводнів гомологічного ряду метану (алканів) –
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Сполуки Кальцію. Кальцій оксид.
Завдання скеровано на перевірку знання хімічних властивостей кальцій оксиду.
Кальцій оксид – типовий основний оксид. Він реагує із карбон(IV) оксидом і (1) сульфатною кислотою (2). Як оксид активного металічного елемента реагує з водою (5):
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
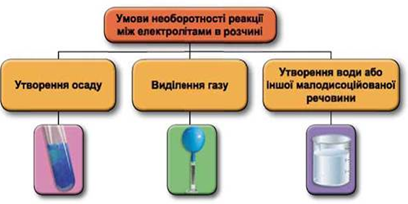
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція обміну в розчині між сіллю Магнію і лугом:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Генетичні зв’язки між основними класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами неорганічних сполук.
Речовиною
є кислотний карбон(IV) оксид:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення. Окисно-відновні реакції.
Завдання скеровано на перевірку вміння розпізнавати окисно-відновні реакції.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
З-поміж наведених рівнянь реакцій умову завдання задовольняє варіант
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Амінокислоти.
Завдання скеровано на перевірку знання способів добування амінокислот.
Амонієва сіль аміноетанової кислоти є продуктом реакції хлороетанової кислоти з амоніаком:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Ферум(ІІ) оксид. Сульфатна кислота.
Завдання скеровано на перевірку знання властивостей ферум(ІІ) оксиду й сульфатної кислоти.
Ферум(ІІ) оксид реагує з розведеною сульфатною кислотою з утворенням ферум(ІІ) сульфату й води:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Хімічні властивості метану.
Завдання скеровано на перевірку знання хімічних властивостей метану.
Хлорометан є продуктом першої стадії хлорування метану:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Хімічні властивості ферум(ІІІ) оксиду.
Завдання скеровано на перевірку знання хімічних властивостей ферум(ІІІ) оксиду.
Ферум(ІІІ) оксид є амфотерним, оскільки реагує як із кислотами, так і з лугами:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між органічними речовинами різних класів. Естери.
Завдання скеровано на перевірку розуміння суті реакції естерифікації, уміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
У завданні наведено структурну формулу етилового естеру 2-метилпропанової кислоти:
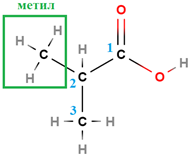 |
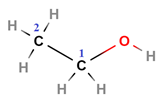 |
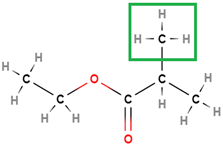 |
| 2-Метилпропанова кислота | Етанол | Етил-2-метилпропаноат |
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електроліз.
Завдання скеровано на перевірку вміння прогнозувати продукти електролізу водних розчинів солей.
Електроліз – розкладання речовин (наприклад, води, розчинів кислот, лугів, розчинених або розплавлених солей тощо) постійним електричним струмом.
Електроліз полягає в електрохімічних процесах окиснення та відновлення на електродах. Під час електролізу позитивно заряджені йони (катіони) рухаються до катода, на якому електрохімічно відновлюються. Негативно заряджені йони (аніони) рухаються до анода, де електрохімічно окиснюються:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ферум. Залізо. Виробництво чавуну.
Завдання скеровано на перевірку знання хімізму виробництва чавуну.
Складниками шихти доменного виробництва чавуну (рис. 1) є залізна руда (1), флюси (2), кокс (3).
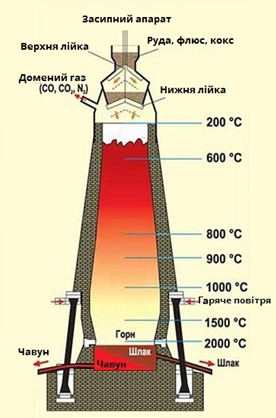
Рис. 1. Доменне виробництво чавуну
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
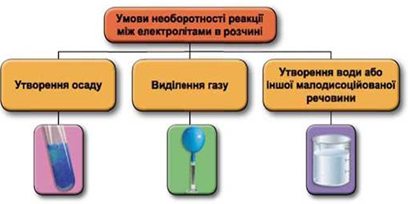
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція обміну в розчині між сильною кислотою (наприклад хлоридною) і середньою сіллю (силікатом):
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
Умову завдання задовольняє реакція магнію (простої речовини) із сульфатною кислотою (складною речовиною). Продуктами реакції є магній сульфат (складна речовина) і водень (проста речовина). Атоми Магнію заміщують атоми Гідрогену в молекулах сульфатної кислоти.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Металічні й неметалічні елементи. Металургія.
Завдання скеровано на перевірку знання способів боротьби із забрудненням довкілля під час виробництва металів і сплавів.
У металургії важливими способами боротьби із забрудненням довкілля є комплексне використання сировини (1) і заміна коксу воднем (2).
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Кальцій оксид і кальцій гідроксид.
Завдання скеровано на перевірку знання застосування сполук Кальцію.
Вапняне молоко, суспензія гашеного вапна
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичний зв’язок між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичний зв’язок між органічними сполуками.
Умову завдання задовольняє етилетаноат:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електронні формули атомів, йонів.
Завдання скеровано на перевірку вміння складати електронні формули атомів, йонів.
| Символ хімічного елемента | Протонне число | Кількість електронів | Електронно-графічна формула |
Кількість неспарених електронів | ||
| 1 | 6 | 6 | 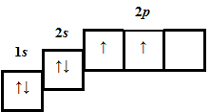 |
2 | B | |
| 2 | 19 | 19 | 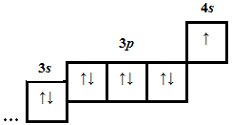 |
1 | Б | |
| 3 | 7 | 7 | 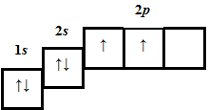 |
3 | A | |
| 4 | 20 | 18 | 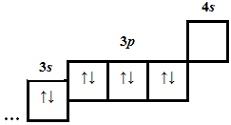 |
0 | Г |
Відповідь: 1В, 2Б, 3А, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
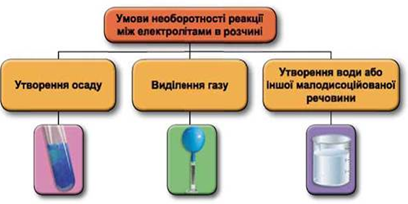
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
| Назва реагентів | Молекулярне та йонно-молекулярні рівняння | ||
| 1 | аргентум(І) нітрат і барій хлорид |
|
B |
| 2 | ферум(III) оксид і нітратна кислота |
|
Д |
| 3 | калій гідроксид і сульфатна кислота |
|
A |
| 4 | ферум(II) сульфід і хлоридна кислота |
|
Г |
Відповідь: 1В, 2Д, 3А, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Застосування органічних й неорганічних речовин.
Завдання скеровано на перевірку розуміння зумовленості застосування речовин їхніми властивостями.
| Речовина | |||
| Назва | Галузь застосування | ||
| 1 | амофос | добриво | Б |
| 2 | алюміній, сплави алюмінію | пакувальний матеріал (фольга, бокси) | Г |
| 3 | натрій стеарат | мило | Д |
| 4 | фенол | дезінфікувальний засіб | A |
Відповідь: 1Б, 2Г, 3Д, 4A.
Знайшли помилку? Пишіть на
ТЕМА: Органічні й неорганічні речовини. Хімічні реакції.
Завдання скеровано на перевірку знання умов перебігу хімічних реакцій за участі органічних й неорганічних речовин.
Маса речовини дорівнює добутку її кількості на молярну масу:
| Хімічна реакція | |||
| Схема | Умови здійснення | ||
| 1 | Г | ||
| 2 | A | ||
| 3 | Д | ||
| 4 | ультрафіолетове випромінювання | Б | |
Відповідь: 1Г, 2А, 3Д, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Кількість речовини. Молярна маса.
Завдання скеровано на перевірку розуміння взаємозв’язків між кількістю речовини та її масою.
Маса речовини дорівнює добутку її кількості на молярну масу:
| Речовина | |||||
| Формула | Молярна маса, г/моль | Кількість, моль | Маса (г) | ||
| 1 | 56 | 1,5 | 84 | Г | |
| 2 | 2 | 0,5 | 1 | A | |
| 3 | 18 | 3 | 54 | Д | |
| 4 | 100 | 2 | 200 | B | |
Відповідь: 1Г, 2А, 3Д, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова речовини. Електронегативність. Хімічний зв’язок.
Завдання скеровано на перевірку розуміння змісту понять електронегативність і полярність хімічного зв’язку.
Електронегативність хімічного елемента – це властивість його атома притягувати спільні з іншим атомом електронні пари. У групах електронегативність атомів хімічних елементів зі збільшенням їхніх протонних чисел (порядкових номерів) зменшується, а в періодах – збільшується (рис. 1).

Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Ковалентний зв’язок, у якому одна чи кілька спільних електронних пар зміщені в бік електронегативнішого атома, називають полярним зв’язком.
Полярність хімічного зв’язку то більша, що більша різниця електронегативностей атомів, між якими він утворюється.
Відповідь: Г В А Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
Відповідь: А В Б Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електроліти. Електролітична дисоціація.
Завдання скеровано на перевірку вміння складати й тлумачити рівняння електролітичної дисоціації.
| Рівняння електролітичної дисоціації | Загальна кількість (моль) йонів унаслідок дисоціації солі кількістю речовини 1 моль | |
| 2 | Б | |
| 3 | A | |
| 4 | Г | |
| 5 | B |
Відповідь: Б А Г В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни радіусів атомів хімічних елементів у групах і періодах періодичної системи.
Радіус атома – це відстань від центра його ядра до сферичної поверхні, на якій найчастіше трапляються електрони зовнішнього енергетичного рівня.
У періодах зі зростанням протонного числа радіус атомів зменшується.
У головних підгрупах зі зростанням протонного числа радіус атомів зростає (рис. 1).
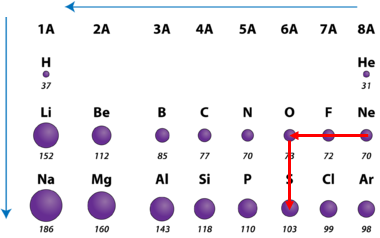
Рис. 1. Закономірності зміни радіусів атомів у періодах і групах періодичної системи
Відповідь: А Г В Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
Відповідь: В А Г Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
Відповідь: В А Г Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Сірка. Сполуки Сульфуру.
Завдання скеровано на перевірку знання умов перебігу хімічних реакцій за участі сірки та сполук Сульфуру.
Відповідь: Г Б А В.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Залізо. Сполуки Феруму. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами речовин.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду:
Відповідь: Г А В Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти.
Завдання скеровано на перевірку вміння класифікувати кислоти за основністю.
Основність кислоти визначають за кількістю атомів Гідрогену в її молекулі, які здатні заміщуватися атомами металічних елементів:
Відповідь: А Б Г В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
Відповідь: Г В Б А.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Визначення молекулярної формули речовини за масовими частками хімічних елементів у ній і відносною густиною.
Завдання скеровано на перевірку вміння визначати найпростішу формулу речовини за масовими частками хімічних елементів у ній і молярною масою.
Дано:
Знайти:
Відповідь: 28.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічним рівнянням об’єму газуватого реагенту за відомою масою іншого реагенту.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням об’єм газуватого реагенту за відомим об’ємом іншого газуватого реагенту.
Дано:
Знайти:
Відповідь: 80.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів –
Відповідь: 18.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення молярної маси речовини за хімічною формулою.
Завдання скеровано на перевірку вміння розпізнавати аніони за допомогою якісних реакцій та обчислювати молярну масу речовини за хімічною формулою.
Умову завдання задовольняє силікат-аніон. Під дією хлоридної кислоти на розчинний силікат випадає склоподібний осад силікатної кислоти. Осад розчиняється внаслідок нейтралізації кислоти лугом.
Відповідь: 76.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічним рівнянням об’єму газуватого реагенту за відомою масою іншого реагенту.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням об’єм газуватого реагенту за відомою масою продукту реакції та його відносним виходом.
Дано:
Знайти:
Відповідь: 112.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення відносної молекулярної маси за формулою речовини.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу за формулою речовини.
Дано:
Знайти:
Відповідь: 222.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електроліз. Обчислення в хімії.
Завдання скеровано на перевірку вміння прогнозувати продукти електролізу водних розчинів солей та обчислювати об’єм газуватого продукту електролізу за масою іншого продукту.
Електроліз – розкладання речовин (наприклад, води, розчинів кислот, лугів, розчинених або розплавлених солей тощо) постійним електричним струмом.
Електроліз полягає в електрохімічних процесах окиснення та відновлення на електродах. Під час електролізу позитивно заряджені йони (катіони) рухаються до катода, на якому електрохімічно відновлюються. Негативно заряджені йони (аніони) рухаються до анода, де електрохімічно окиснюються. Під час електролізу солей малоактивних металічних елементів й оксигеновмісних кислот на катоді відновлюються катіони металічного елемента, а на аноді окиснюються молекули води:
Дано:
Знайти:
Відповідь: 28.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Визначення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 30
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічним рівнянням об’єму газуватого реагенту за відомим об’ємом іншого газуватого реагенту.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням об’єм газуватого реагенту за відомою масою продукту реакції та його відносним виходом.
Дано:
Знайти:
Відповідь: 600.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічним рівнянням кількості речовини газуватого продукту за відомою масою реагенту й масовою часткою домішок у ньому.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням кількості речовини газуватого продукту за відомою масою реагенту й масовою часткою домішок у ньому.
Дано:
Знайти:
Відповідь: 2.
Знайшли помилку? Пишіть на




