ЗНО онлайн 2013 року з хімії – основна сесія
Тестові завдання основної сесії ЗНО 2013 року з хімії
ТЕМА: Основні хімічні поняття. Хімічний елемент. Хімічна формула.
Завдання скеровано на перевірку вміння аналізувати якісний (елементний) і кількісний склад речовини за її хімічною формулою.
Хімічна формула – запис, що показує, якісний (визначають за хімічними символами) і кількісний (визначають за правими підрядковими індексами) склад речовини.
За наведеною в умові завдання формулою можна визначити кількість видів атомів (хімічних елементів) у кожній речовині:
А один хімічний елемент (
Б три хімічні елементи (
В два хімічні елементи (
Г два хімічні елементи (
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Основні хімічні поняття. Хімічна формула. Молярна маса. Кількісні відношення в хімії.
Завдання скеровано на перевірку вміння обчислювати молярну масу речовини за її хімічною формулою.
Молярна маса – маса речовини кількістю 1 моль чисельно дорівнює відносній молекулярній масі, яку обчислюють як суму добутків відносних атомних мас хімічних елементів і правих підрядкових індексів біля їхніх хімічних символів у формулі.
Для натрій ортофосфатної кислоти
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Періодичний закон і періодична система хімічних елементів. Металічні й неметалічні елементи.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
На початку кожного періоду (окрім першого) лужний елемент, наприкінці – інертний.
У періодах зі збільшенням атомних мас металічний характер елементів послаблюється, а неметалічний – посилюється.
Побічні підгрупи утворені елементами лише великих періодів. Усі ці елементи – металічні.
А
Б
В
Г
Натрій – лужний елемент, Берилій – металічний елемент, Ферум – металічний елемент (рис. 1).
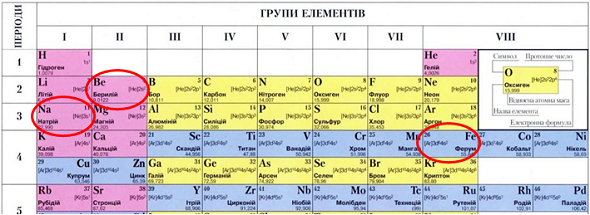
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Будова атома. Нукліди. Ізотопи.
Завдання скеровано на перевірку вміння аналізувати склад нуклідів.
Нуклідний символ – символ хімічного елемента, біля якого зазначені: масове (нуклонне) число – лівий верхній індекс, атомний номер – лівий нижній індекс.
| Нуклідний символ | |
| Кількість електронів (дорівнює протонному числу й порядковому номеру хімічного елемента в періодичній системі) | 17 |
| Нуклонне число (дорівнює сумі кількості протонів і нейтронів) | 37 |
| Кількість нейтронів (дорівнює різниці нуклонного й протонного чисел) | 20 (37-17) |
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки. Йонний зв’язок.
Завдання скеровано на перевірку розуміння змісту поняття кристалічні ґратки, уміння прогнозувати тип кристалічних ґраток у речовині за її хімічною формулою.
Йонний зв’язок – це зв’язок між катіонами й аніонами. Його можна розглядати як граничний випадок ковалентного полярного зв’язку. Якщо різниця в значеннях електронегативності атомів хімічних елементів дуже велика (рис. 1), спільні електронні пари практично повністю зміщуються до атома більш електронегативного елемента. За цих умов атоми перетворюються на йони.
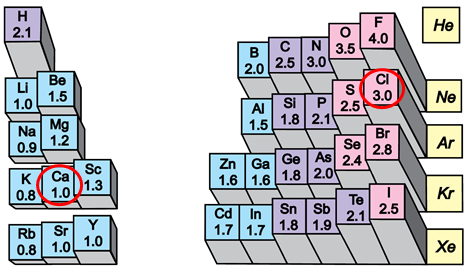
Рис. 1. Відносна електронегативність хімічних елементів
Умову завдання задовольняє кальцій хлорид. У вузлах кристалічних ґраток цієї солі містяться катіони Кальцію і хлорид-аніони.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Періодичний закон і періодична система хімічних елементів. Будова атома.
Завдання скеровано на перевірку вміння визначати протонне число хімічного елемента за його місцем у періодичній системі.
У четвертому періоді VІІ групі головній підгрупі міститься Бром. Його порядковий номер 35, тож і протонне число цього хімічного елемент – 35.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Швидкість хімічної реакції.
Завдання скеровано на перевірку розуміння впливу різних чинників на швидкість хімічної реакції.
Швидкість хімічної реакції – це швидкість утворення її продуктів або витрачання реагентів.
Швидкість хімічної реакції можна збільшити, якщо використати каталізатор. Він змінює механізм реакції, пришвидшує її перебіг.
Площа поверхні контактування реагентів – чинник, від якого залежить швидкість хімічної реакції. Подрібнення і розпорошення зумовлюють збільшення імовірності стикання активних частинок речовин-реагентів.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Тепловий ефект хімічної реакції.
Завдання скеровано на перевірку розуміння суті теплового ефекту хімічної реакції, уміння аналізувати графіки.
Унаслідок хімічних реакцій руйнуються зв’язки в речовинах-реагентах, утворюються нові зв’язки, і, як наслідок, – нові речовини. Ці процеси відбуваються з виділенням або поглинанням енергії.
Енергію, виділену або поглинуту системою під час перебігу в ній хімічної реакції, називають тепловим ефектом реакції. Це різниця між внутрішньою енергією продуктів реакції і реагентів.
На графіку тепловому ефекту хімічної реакції відповідає відрізок 2.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні, кислотні, амфотерні оксиди й прогнозувати перебіг реакції між оксидами й водою.
Класифікацію оксидів за їхнім складом і хімічними властивостями наведено на рисунку 1.
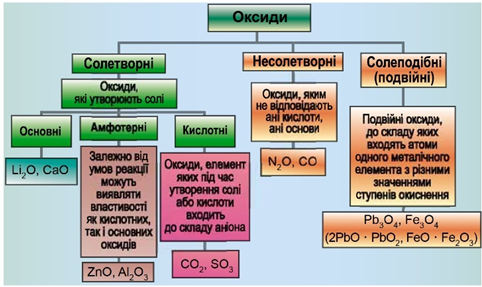
Рис. 1. Класифікація оксидів
До основних оксидів належать:
- оксиди всіх металічних елементів головної підгрупи першої групи;
- оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію (
\(\mathrm{Mg – Ra}\) ); - оксиди металічних елементів у нижчих значеннях валентності, наприклад
\(\mathrm{MnO,\ FeO}\) .
Кислотними оксидами є більшість оксидів неметалічних елементів (
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Із-поміж оксидів, формули яких наведено в умові, лише сульфур(VІ) оксид є кислотними, реагує з водою з утворенням сульфатної кислоти:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Суміші.
Завдання скеровано на перевірку вміння класифікувати суміші, розпізнавати суспензії.
Суспензії є різновидом неоднорідних сумішей. Це зависі твердих частинок у рідкому середовищі.
Крейда, головним складником якої є кальцій карбонат, не розчиняється у воді. Унаслідок змішування крейди з водою утвориться каламутна завись частинок крейди у воді – суспензія, яка згодом під дією сили земного тяжіння розшарується: шар води над осадом крейди.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Суміші. Неорганічна хімія. Неметали.
Завдання скеровано на перевірку вміння добирати спосіб розділення суміші з огляду на її склад.
Пісок, силіцій – тверді нелеткі речовини. Бром – рідина (температура тверднення −7,25 °C), яка не може кристалізуватися за умов, описаних у завданні. Йод – летка кристалічна речовина. Атоми йоду в молекулі сполучені досить міцними ковалентними зв’язками, а його молекули між собою – слабкими силами. Тому вже за незначного нагрівання йод не плавиться, а переходить з кристалічного стану в газуватий (зазнає сублімації), за охолодження пара йоду кристалізується.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Луги.
Завдання скеровано на перевірку знання властивостей лугів.
1) калій гідроксид добре розчиняється у воді, це луг – розчинна основа;
2) луги стійкі до окиснення;
3) калій гідроксид реагує з кислотними оксидами, зокрема сульфур(IV) оксидом:
4) калій гідроксид – сильний електроліт, який у водному розчині дисоціює на катіони Калію і гідроксид-аніони:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти.
Завдання скеровано на перевірку знання властивостей неорганічних сполук, уміння порівнювати їхні властивості.
Класифікацію кислот схематично зображено на рисунку 1.
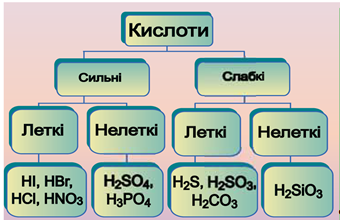
Рис. 1. Класифікація кислот
Продуктом розчинення сульфур(IV) оксиду у воді є слабка сульфітна кислота:
Унаслідок розчинення гідроген сульфіду у воді утворюється слабка сульфідна кислота
Унаслідок розчинення гідроген хлориду
Унаслідок розчинення амоніаку у воді утворюється лужний розчин:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неорганічні речовини і їхні властивості. Поняття про твердість (жорсткість) води та способи її усунення.
Завдання скеровано на перевірку знання чинників, що зумовлюють постійну твердість води та способів пом’якшення води.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів у ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють із певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Тимчасову (карбонатну) твердість води зумовлено катіонами
Для пом’якшення води використовують кип’ятіння, що забезпечує перетворення розчинних гідрогенкарбонатів Кальцію і Магнію на нерозчинні карбонати цих елементів:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини і їхні властивості. Амфотерність. Цинк гідроксид.
Завдання скеровано на перевірку розуміння суті амфотерності.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості. З кислотами цинк гідроксид
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
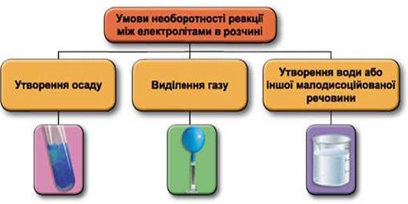
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині реагують купрум(ІІ) сульфат і натрій гідроксид, унаслідок цього утворюється осад купрум(ІІ) гідроксиду:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Реакції солей у розчинах із металами.
Завдання скеровано на перевірку знання хімічних властивостей металів; розуміння, за яких умов метал реагує із сіллю.
Скориставшись довідковою таблицею «Ряд активності металів» (рис. 1), можна визначити, що з-поміж наведених металів лише цинк реагуватиме з ферум(ІІ) сульфатом у водному розчині, оскільки в ряду активності він розташований лівіше від заліза:
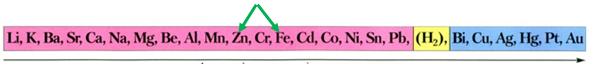
Рис. 1. Ряд активності металів
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Основні класи неорганічних сполук. Основи.
Завдання скеровано на перевірку знання хімічних властивостей нерозчинних основ.
Продуктами термічного розкладання нерозчинних основ є відповідний оксид і вода:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Хімічні властивості алюмінію. Обчислення в хімії.
Завдання скеровано на перевірку вміння складати рівняння реакцій за участі алюмінію й виконувати обчислення за ними.
Продуктом окиснення алюмінію є алюміній оксид:
За рівнянням реакції можна визначити, що кількість речовини алюміній оксиду вдвічі менша за кількість речовини алюмінію і становить 2 моль.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини. Залізо.
Завдання скеровано на перевірку знання хімічних властивостей заліза. Під дією концентрованих сульфатної та нітратної кислот на поверхні заліза утворюється стійка оксидна плівка.
З-поміж наведених варіантів умову завдання задовольняє варіант, у якому наведено формулу сульфатної кислоти й зазначено, що вона концентрована.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Групи хімічних елементів.
Завдання скеровано на перевірку вміння прогнозувати можливість перебігу реакцій за участі галогенів і їхніх сполук.
Хлор як активніший галоген витісняє менш активні галогени
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку розуміння змісту поняття ступінь окиснення, уміння визначати ступені окиснення атомів хімічних елементів за формулами речовин.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену, Оксигену й Флуору у складних речовинах зазвичай становлять +1, –2 і –1 відповідно.
Однакові ступені окиснення Сульфуру в сульфур(IV) оксиді й сульфур(IV) флуориді:
A
Б
B
Г
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Амоніак.
Завдання скеровано на перевірку знання тривіальних назв деяких неорганічних речовин.
Хімічна формула амоніаку
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Карбон(ІV) оксид.
Завдання скеровано на перевірку знання хімічних властивостей карбон(ІV) оксиду й уміння прогнозувати можливість перебігу реакцій за його участі.
Карбон(ІV) оксид є кислотним, йому відповідає слабка карбонатна кислота. Як кислотний оксид він реагує з лугами (гідроксидами Натрію і Барію) та з основним калій оксидом.
З іншим кислотним силіцій(ІV) оксидом карбон(ІV) оксид не реагує.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні поняття органічної хімії. Гомологія.
Завдання скеровано на перевірку розуміння суті гомології та гомологічної різниці.
Послідовний ряд сполук, кожен член у якому відрізняється від сусіднього на однаковий атом чи ланку, зокрема на ланку
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура спиртів.
Завдання скеровано на перевірку вміння називати насичені ациклічні спирти за систематичною номенклатурою.
Називати насичені ациклічні спирти за систематичною номенклатурою потрібно за алгоритмом, наведеним на схемі (рис. 1).
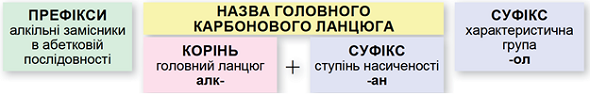
Рис. 1. Алгоритм побудови назв насичених ациклічних спиртів за систематичною номенклатурою
Важливо пам’ятати:
- потрібно нумерувати карбоновий ланцюг із того кінця, до якого ближче розташована гідроксильна група;
- якщо гідроксильна група рівновіддалена від обох кінців головного карбонового ланцюга, то нумерують із того кінця, до якого ближче розташований алкільний замісник;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, то його нумерують так, щоб замісник, назву якого за абеткою вживають раніше, був позначений найменшим числом;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, але з одного кінця замісників більше, то нумерацію проводять з урахуванням положення замісників, позначених найменшими числами.
Вибір головного ланцюга й нумерацію атомів Карбону в ньому за цим алгоритмом зображено на рисунку 2.
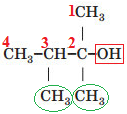
Рис. 2. Вибір головного ланцюга й нумерація атомів Карбону в ньому
У головному ланцюгу чотири атоми Карбону, із другим атомом Карбону в ньому сполучено характеристичну гідроксильну групу
Назва спирту – 2,3-диметилбутан-2-ол.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні поняття органічної хімії. Гомологія. Алкани.
Завдання скеровано на перевірку розуміння суті гомології та гомологічної різниці, уміння визначати формули членів гомологічного ряду.
Послідовний ряд сполук, кожен член у якому вiдрiзняється вiд сусiднього на однаковий атом чи ланку, зокрема на ланку
Загальна формула алканів
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні поняття органічної хімії. Типи реакцій в органічній хімії.
Завдання скеровано на перевірку знання хімічних властивостей алкенів й уміння класифікувати хімічні реакції за їхньої участі.
Гідратація алкенів полягає в приєднанні молекули води до молекули алкену за місцем подвійного зв’язку.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура алкінів.
Завдання скеровано на перевірку знання номенклатури алкінів.
Бутин – алкін, у молекулі якого чотири атоми Карбону. Загальна формула алкінів
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Типи реакцій в органічній хімії. Бензен.
Завдання скеровано на перевірку знання хімічних властивостей бензену й уміння класифікувати хімічні реакції за його участі.
Унаслідок опромінення суміші бензену з хлором відбувається реакція приєднання:
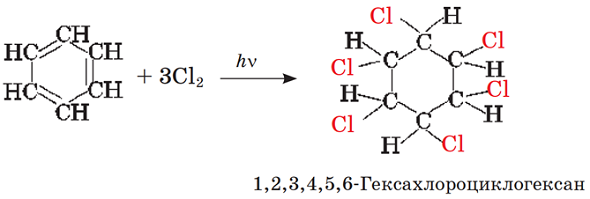
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Природні джерела вуглеводнів.
Завдання скеровано на перевірку знання видів екологічно чистого палива.
Продуктом згоряння водню є вода. Тому спалювання водню завдає меншої шкоди природі порівняно з вуглеводневим паливом.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Спирти.
Завдання скеровано на перевірку знання хімічних властивостей спиртів і вміння встановлювати генетичні зв’язки між класами органічних сполук.
Умову завдання задовольняє речовина, яка належить до насичених спиртів.
У молекулах спиртів є характеристична гідроксильна група (одна чи кілька), тому спирт реагує з натрієм з виділенням водню і з гідрогенхлоридом з утворенням хлороалкану:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Альдегіди.
Завдання скеровано на перевірку знання хімічних властивостей альдегідів і якісних реакцій альдегідної характеристичної групи.
Реакція «срібного дзеркала» є якісною реакцією на альдегідну групу:
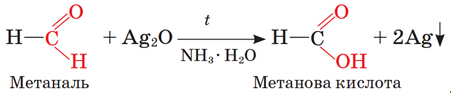
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Карбонові кислоти.
Завдання скеровано на перевірку знання складу та будови карбонових кислот.
Молекули одноосновних карбонових кислот складаються з вуглеводневого замісника
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Естери. Жири.
Завдання скеровано на перевірку знання природи жирів.
Жири – продукти реакції естерифікації, що відбувається за участі гліцеролу й вищих карбонових кислот – пальмітинової
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Вуглеводи.
Завдання скеровано на перевірку знання хімічних властивостей вуглеводнів.
Крохмаль – полісахарид. Його молекули утворені залишками молекул глюкози. Тож гідролізом крохмалю добувають глюкозу:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Анілін.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами органічних сполук.
Умову завдання задовольняє нітробензен, відновленням якого добувають анілін – ароматичний амін:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Амінокислоти. Білки.
Завдання скеровано на перевірку знання складу й хімічних властивостей амінокислот.
Зв’язок між залишками амінокислот називають пептидним (або амідним) зв’язком, а групу 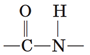 пептидною (або амідною) групою. Молекули амінокислот взаємодіють між собою. У реакцію вступають протилежні за функціями групи: карбоксильна група
пептидною (або амідною) групою. Молекули амінокислот взаємодіють між собою. У реакцію вступають протилежні за функціями групи: карбоксильна група
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Амінокислоти. Білки.
Завдання скеровано на перевірку знання складу молекул білків.
Білки – біополімери. Молекули білків утворені залишками амінокислот. Унаслідок гідролізу білок розщеплюється на амінокислоти, із залишків яких він побудований.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Реакції йонного обміну. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
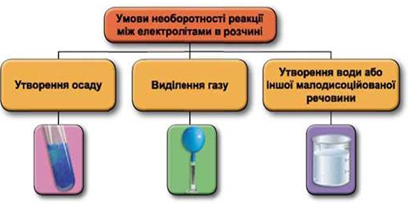
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
У водному розчині реагують натрій сульфат і барій гідроксид, унаслідок цього утворюється осад барій сульфату й розчин натрій гідроксиду:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за хімічним складом і кількістю реагентів і продуктів, зміною ступенів окиснення хімічних елементів.
| 1 | У реакції беруть участь дві складні речовини, утворюється одна складна речовина. Це реакція сполучення без зміни ступенів окиснення
|
Д |
| 2 | У реакції бере участь одна складна речовина, утворюються три складні речовина. Це реакція розкладання без зміни ступенів окиснення
|
A |
| 3 | Протонне число У реакції бере участь одна складна речовина, утворюються дві складні речовина. Це окисно-відновна реакція розкладання
|
B |
| 4 | У реакції беруть участь дві прості речовини, утворюється одна складна речовина. Це окисно-відновна реакція сполучення
|
Г |
Відповідь: 1Д, 2А, 3В, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Тривіальні назви неорганічних речовин.
Завдання скеровано на перевірку знання тривіальних назв неорганічних речовин.
| Назва речовини | Хімічна формула | |||
| тривіальна | систематична | |||
| 1 | негашене вапно | кальцій оксид | B | |
| 2 | поташ | калій карбонат | Д | |
| 3 | гіпс | кальцій сульфат дигідрат | Г | |
| 4 | сухий лід | карбон(VІ) оксид | Б | |
Відповідь: 1В, 2Д, 3Г, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Застосування органічних речовин.
Завдання скеровано на перевірку знання типів хімічних реакцій і галузей застосування органічних речовин.
| Хімічна реакція | Продукт реакції | Використання основного продукту реакції | ||
| 1 | гідроліз кальцій карбіду | етин | автогенне зварювання металів | A |
| 2 | гідратація етену | етанол | розчинник у парфумерії | Д |
| 3 | нітрування гліцеролу | тринітрогліцерол | вибухівка | Б |
| 4 | полімеризація етену | поліетилен | пакувальний матеріал | Г |
Відповідь: 1А, 2Д, 3Б, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Спирти.
Завдання скеровано на перевірку вміння класифікувати спирти.
| Природа спирту | Формула спирту | Використання основного продукту реакції | ||
| 1 | первинний | 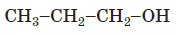 |
Залежно від положення гідроксигрупи (ії розташування біля первинного, вторинного чи третинного атома Карбону) розрізняють первинні, вторинні, третинні спирти | Г |
| 2 | вторинний | 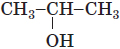 |
A | |
| 3 | третинний | 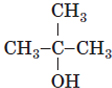 |
Д | |
| 4 | двохатомний | 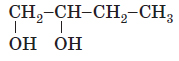 |
Залежно від кількості гідроксигруп спирти поділяють на одноатомні, двохатомні та багатоатомні | B |
Відповідь: 1Г, 2А, 3Д, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Будова атомів.
Завдання скеровано на перевірку знання закономірностей зміни в періодичній системі кількості електронів на зовнішньому енергетичному рівні в атомах.
| Символ хімічного елемента | Номер групи в періодичній системі хімічних елементів (короткоперіодна форма) | Кількість електронів на зовнішньому енергетичному рівні атома | ||
| A | ІІІА | 3 | 3 | |
| Б | ІІА | 2 | 2 | |
| B | ІА | 1 | 1 | |
| Г | IVА | 4 | 4 |
Відповідь: В, Б, А, Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни металічних і неметалічних властивостей хімічних елементів у періодичній системі.
Усі хімічні елементи, про які йдеться в завданні, розташовані в другому періоді періодичної системи (рис. 1). У періодах зі збільшенням протонного числа посилюються неметалічні властивості хімічних елементів.

Рис. 1. Елементи другого періоду періодичної системи хімічних елементів
Відповідь: В, Б, А, Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Генетичний зв’язок між основними класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичний зв’язок між неорганічними сполуками різних класів.
Послідовність перетворень металу на кислу сіль така:
Відповідь: Г, В, Б, А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами сполук.
А
Б
B
Г
Відповідь: Г, Б, В, А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Генетичний зв’язок між основними класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичний зв’язок між органічними сполуками різних класів.
Послідовність перетворень сполук під час синтезу аміноетанової кислоти така:
Відповідь: Г, Б, В, А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Генетичний зв’язок між основними класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичний зв’язок між органічними сполуками різних класів.
Послідовність перетворень сполук під час синтезу фенолу така:
Відповідь: В, А, Б, Г.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Сума коефіцієнтів –
Відповідь: 14.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати масу продукту реакції за відомим об’ємом газуватого реагенту й виходом продукту від теоретичного.
Дано:
Знайти:
Відповідь: 828.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Виведення хімічної формули.
Завдання скеровано на перевірку вміння визначати хімічну формулу вищого оксиду за місцем елемента в періодичній системі хімічних елементів.
Порядковий номер
Відповідь: 4.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями. Комбіновані задачі.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 74.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння обчислювати ступінь електролітичної дисоціації.
Ступінь дисоціації – відношення кількості молекул, які розпалися на йони, до загальної їхньої кількості.
Відповідь: 8.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати масу продукту реакції за хімічним рівнянням, якщо один із реагентів узято в надлишку.
Дано:
Знайти:
Відповідь: 10.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати об’єм газуватого продукту реакції за кількістю речовини реагенту.
Дано:
Знайти:
Відповідь: 224.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 10.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями. Комбіновані задачі.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 95.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати кількість речовини реагенту за відомим об’ємом іншого газуватого реагенту.
Дано:
Знайти:
Відповідь: 10.
Знайшли помилку? Пишіть на




