ЗНО онлайн 2012 року з хімії – основна сесія
Тестові завдання основної сесії ЗНО 2012 року з хімії
ТЕМА: Загальна хімія. Основні хімічні поняття. Хімічний елемент. Молярна маса.
Завдання скеровано на перевірку знання позначень фізичних величин.
Молярна маса – маса речовини кількістю
Тож молярну масу Натрію позначено записом
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні хімічні поняття. Молярна маса. Молярний об’єм.
Завдання скеровано на перевірку розуміння фізичного змісту молярної маси й молярного об’єму.
Молярна маса – маса речовини кількістю
Молярний об’єм – об’єм речовини кількістю
Густина речовини – відношення її маси до об’єму.
За нормальних умов
Частка від ділення середньої молярної маси повітря на молярний об’єм газів (н. у.) – це густина повітря.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Структура періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати структуру періодичної системи хімічних елементів.
А наприкінці кожного періоду розташовані неметалічні елементи – галогени й інертні
Б кожен період починається лужним елементом
В головні підгрупи містять як металічні, так і неметалічні елементи
Г побічні підгрупи містять лише металічні елементи
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Нукліди.
Завдання скеровано на перевірку вміння аналізувати склад нуклідів.
Різновид атомів з певною кількістю нейтронів називають нуклідом.
Нукліди
| Нуклідний символ | Протонне число | Кількість електронів | Нуклонне число | Кількість нейтронів |
| 17 | 17 | 35 | 18 | |
| 37 | 20 |
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічний зв’язок. Ковалентний неполярний зв’язок.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу й визначати тип хімічного зв’язку в речовині.
Хімічним зв’язком називають сили, які утримують атоми в молекулах або кристалах. Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку з вісьмох електронів. Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул. Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільної електронної пари розподілений між ними порівну. Такий зв’язок називають ковалентним неполярним.
Із-поміж речовин, формули яких наведено у завданні, умову задовольняє азот

Рис. 1. Електронна формула молекули азоту
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова речовини. Кристалічні ґратки.
Завдання скеровано на перевірку вміння визначати тип кристалічних ґраток у речовині.
У вузлах кристалічних ґраток натрій гідроксиду містяться йони – катіони Натрію і гідроксид-аніони. Тобто йдеться про йонні кристалічні ґратки.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Швидкість хімічної реакції.
Завдання скеровано на перевірку знання залежності швидкості хімічної реакції від різних чинників.
Швидкість хімічної реакції – поняття, яке характеризує швидкість утворення її продуктів або витрати реагентів.
Щоби під час зіткнення частинок реагентів зруйнувалися старі й утворилися нові хімічні зв’язки, енергія цих частинок має сягнути певної мінімальної величини (або перевищити її).
Швидкість хімічної реакції залежить від природи реагентів, їхньої концентрації, площі поверхні контактування, температури, каталізатора тощо.
Швидкість хімічної реакції зростає внаслідок подрібнення реагентів і збільшення їхньої концентрації.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислоти. Луги. Індикатори. Реакція нейтралізації.
Завдання скеровано на перевірку розуміння суті реакції нейтралізації та знання кольорів індикаторів у різних середовищах – лужному, кислому, нейтральному.
У водному розчині калій гідроксиду є гідроксид-аніони, під дією яких фенолфталеїн набуває малинового кольору. Унаслідок поступового додавання хлоридної кислоти відбувається реакція нейтралізації, гідроксид-аніони реагують із катіонами Гідрогену:
Тому учень, який до розбавленого водного розчину калій гідроксиду, підфарбованого фенолфталеїном, поступово добавлятиме хлоридну кислоту, спостерігатиме знебарвлення розчину.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електроліти. Електролітична дисоціація.
Завдання скеровано на перевірку вміння складати й інтерпретувати рівняння електролітичної дисоціації.
Натрій сульфат – добре розчинна у воді середня сіль, яка дисоціює на катіони Натрію і сульфат-аніони:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Розчини. Розчинність.
Завдання скеровано на перевірку знання впливу різних чинників на розчинність речовин.
Розчинність – це максимальна маса (г) речовини, яка може за певних умов (температури, тиску) розчинитися в розчиннику масою
Розчинність залежить від природи розчинюваної речовини й розчинника, температури й (для газуватих речовин) тиску.
Зі зменшенням тиску розчинність газів у воді зменшується.
На відміну від більшості твердих речовин, розчинність газів у воді зі зростанням температури зменшується.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Оксиди. Класифікація оксидів.
Завдання скеровано на перевірку вміння розпізнавати кислотні оксиди.
Класифікацію оксидів за їхнім складом та хімічними властивостями наведено на рисунку 1.
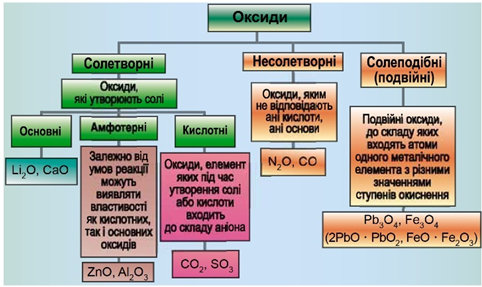
Рис. 1. Класифікація оксидів
Кислотними оксидами є більшість оксидів неметалічних елементів
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Нерозчинні основи.
Завдання скеровано на перевірку знання нерозчинних основ.
Купрум(ІІ) гідроксид є нерозчинною основою, розкладається за нагрівання і реагує з хлоридною кислотою з утворенням солі та води:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Кислотні оксиди, кислоти, генетичні зв’язки між ними.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між кислотними оксидами й кислотами.
Нітратній кислоті
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Розчини. Твердість води.
Завдання скеровано на перевірку знання причин твердості води й способів її пом’якшення.
Твердість води – це сукупність її властивостей, зумовлених деякими катіонами металічних елементів, що містяться в ній. Усі двовалентні катіони тією чи тією мірою впливають на твердість води, оскільки вони взаємодіють з певними аніонами, унаслідок чого утворюються нерозчинні або малорозчинні сполуки, що випадають в осад.
Постійну (некарбонатну) твердість води зумовлено катіонами
Тимчасову (карбонатну) твердість води зумовлено катіонами
Також для усунення тимчасової твердості води використовують кальцій гідроксид, що забезпечує осадження з розчину катіонів Кальцію і Магнію:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Амфотерність. Алюміній оксид.
Завдання скеровано на перевірку розуміння суті амфотерності.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості.
Амфотерні оксиди під час взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У реакціях із лугами або з оксидами лужних і лужноземельних елементів амфотерні оксиди виявляють кислотні властивості.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електролітична дисоціація. Реакції йонного обміну.
Завдання скеровано на перевірку вміння прогнозувати перебіг реакцій між електролітами в розчині, їхні зовнішні ефекти.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
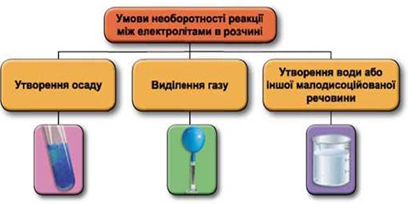
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Реакція у водному розчині відбудеться між натрій сульфатом і барій нітратом:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Металічні елементи. Корозія металів.
Завдання скеровано на перевірку розуміння явища корозії металів і вміння прогнозувати її перебіг з огляду на положення металів у ряду активності (рис. 1).

Рис. 1. Ряд активності металів
Корозія – процес руйнування металів унаслідок їхньої взаємодії з корозивним середовищем.
Що більше різняться між собою за хімічною активністю два метали, що стикаються, тим сильніше кородує активніший із них. Тобто в морській воді в гальванічній парі залізо – цинк кородує цинк, а в гальванічній парі залізо – мідь кородує залізо.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Металічні елементи. Сполуки Кальцію.
Завдання скеровано на перевірку знання тривіальних назв деяких сполук металічних елементів.
Негашене вапно – тривіальна назва кальцій оксиду
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Металічні елементи. Алюміній.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію і вміння складати рівняння реакцій за його участі.
Сума коефіцієнтів:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Металічні елементи. Ферум.
Завдання скеровано на перевірку знання поширеності хімічних елементів в природі.
Складником гемоглобіну є Ферум (рис. 1).
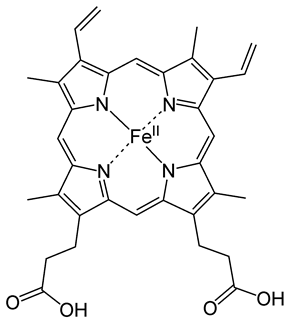
Рис. 1. Структурна формула гема
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Галогени. Гідроген хлорид.
Завдання скеровано на перевірку знання промислових способів добування гідроген хлориду.
Одним зі способів промислового добування гідроген хлориду є синтез із простих речовин:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Сульфур. Сірка. Сполуки Сульфуру.
Завдання скеровано на перевірку знання хімічних властивостей сполук Сульфуру, уміння аналізувати реакції за їхньої участі з погляду окиснення-відновлення.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окисно-відновних реакцій ступені окиснення хімічних елементів змінюються.
Відновник віддає електрони й окиснюється.
Окисник приєднує електрони й відновлюється.
Умову завдання задовольняє реакція між сульфур(IV) оксидом і киснем:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Нітрати.
Завдання скеровано на перевірку вміння складати й інтерпретувати рівняння реакцій термічного розкладання нітратів.
Продукти термічного розкладання нітратів залежно від положення металу в ряду активності наведено на рисунку 1.
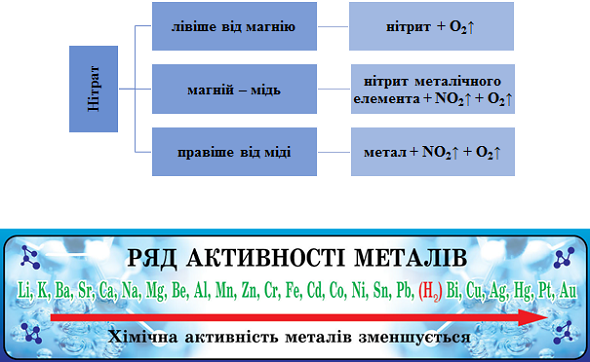
Рис. 1. Продукти термічного розкладання нітратів залежно від положення металу в ряду активності
Сума коефіцієнтів у правій частині рівняння термічного розкладання купрум(ІІ) оксиду дорівнює
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Алотропні видозміни Карбону.
Завдання скеровано на перевірку розуміння поняття алотропія, знання алотропних видозмін Карбону.
Алотропи – різні структурні модифікації одного елемента, мають різні фізичні й хімічні властивості. Алмаз (рис. 1) і графіт (рис. 2) є алотропами Карбону.
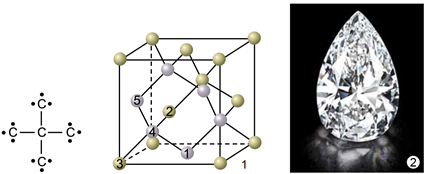
Рис. 1. 1. Модель кристалічних ґраток алмазу. 2. Діамант – огранений алмаз
У кристалічних ґратках алмазу всі щонайближчі між’ядерні відстані й усі кути між чотирма зв’язками атома Карбону рівні. Атоми Карбону в графіті розташовані плоскими сітками.

Рис. 2. 1. Модель кристалічних ґраток графіту. 2. Кристал графіту
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні поняття органічної хімії. Органічні речовини.
Завдання скеровано на перевірку вміння розпізнавати органічні речовини.
Органічна хімія – це хімія сполук Карбону.
Умову завдання серед наведених задовольняє така добірка речовин:
| Метан | Метанова (мурашина) кислота | Хлорометан |
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні поняття органічної хімії. Гомологія. Гомологічний ряд.
Завдання скеровано на перевірку розуміння суті гомології.
Речовини з однаковим якісним складом, подібні за будовою і хімічними властивостями, називають гомологами. За кількісним складом вони відрізняються один від одного на одну або декілька груп
Правильними з-поміж наведених є твердження:
1) група атомів
2) гомологи мають однаковий якісний склад.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Гомологія. Гомологічний ряд.
Завдання скеровано на перевірку вміння розпізнавати молекулярні формули алканів.
Загальна формула алканів –
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Хімічні властивості алкенів. Генетичні зв’язки між вуглеводнями.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між вуглеводнями.
Гідруванням етену добувають етан:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Хімічні властивості алкінів. Генетичні зв’язки між вуглеводнями.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між вуглеводнями.
Гідратацією етину добувають етаналь:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Вуглеводні. Бензен. Генетичні зв’язки між вуглеводнями.
Завдання скеровано на перевірку знання хімічних властивостей і способів добування бензену, уміння встановлювати генетичні зв’язки між вуглеводнями.
Приєднання в бензені відбувається важче, ніж у ненасичених вуглеводнів – бромна вода не знебарвлюється.
І. Бензен не знебарвлює бромну воду.
ІІ. Бензен можна добути тримеризацією етину, а не етану:
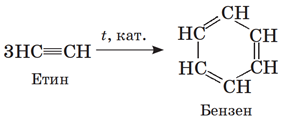
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Природні джерела вуглеводнів. Нафта. Перегонка нафти.
Завдання скеровано на перевірку знання суті перегонки нафти й складу продуктів її розділення на фракції.
Бензин – природна або штучно добута суміш вуглеводнів різної будови, у молекулах яких 5–12 атомів Карбону.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Спирти.
Завдання скеровано на перевірку вміння розрізняти первинні, вторинні та третинні спирти.
Залежно від того, із яким атомом Карбону сполучена гідроксигрупа – одно-, дво- чи тризаміщеним, – спирти поділяють на первинні, вторинні й третинні.
Серед наведених формулою третинного спирту є формула 2-метилпропан-2-олу, у молекулі якого атом Карбону, сполучений із гідроксигрупою, з’єднаний із трьома вуглеводневими замісниками (рис. 1).
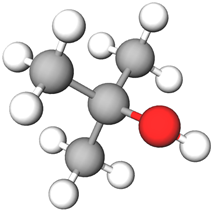
Рис. 1. Модель молекули 2-метилпропан-2-олу
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Альдегіди.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами оксигеновмісних органічних сполук.
Продуктом гідрування етаналю є етанол:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Карбонові кислоти. Метанова кислота.
Завдання скеровано на перевірку знання властивостей метанової кислоти.
Молекула метанової кислоти містить карбоксильну й альдегідну групи (рис. 1).
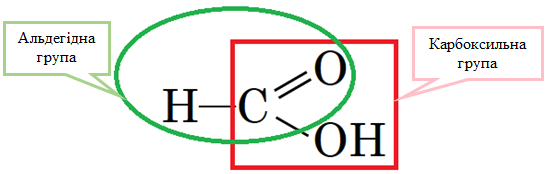
Рис. 1. Структурна формула метанової кислоти
Метанова кислота реагує з лугами, оскільки в її молекулі є карбоксильна група:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Естери. Жири.
Завдання скеровано на перевірку знання хімічних властивостей жирів.
Жири – естери триатомного спирту гліцеролу й вищих карбонових кислот. Гідролізом жирів добувають гліцерол:
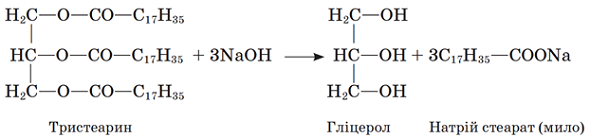
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Вуглеводи.
Завдання скеровано на перевірку знання будови молекули глюкози.
Із-поміж вуглеводів, назви яких наведено в умові завдання, альдегідоспиртом є глюкоза, у молекулі якої є альдегідна та п’ять гідроксильних груп (рис. 1).
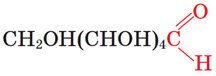
Рис. 1. Глюкоза – альдегідоспирт
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Аміни.
Завдання скеровано на перевірку знання хімічних властивостей амінів і вміння складати та інтерпретувати рівняння реакцій за їхньої участі, застосовувати наслідки із закону Авогадро для хімічних розрахунків.
Продуктами згоряння метиламіну є карбон(ІV) оксид, вода й азот:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Білки.
Завдання скеровано на перевірку знання зовнішніх ефектів ксантопротеїнової реакції.
Поява жовтого забарвлення в результаті реакції білка з концентрованою нітратною кислотою (ксантопротеїнова реакція) свідчить про бензенові ядра в структурі білка.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Полімери. Каучуки.
Завдання скеровано на перевірку розуміння суті реакції полімеризації.
Бутадієновий каучук утворювався полімеризацією бутадієну (бута-1,3-дієну):
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи. Целюлоза.
Завдання скеровано на перевірку знання хімічних властивостей і застосування целюлози.
Целюлоза зазнає гідролізу під час нагрівання з розведеними кислотами й перетворюється на глюкозу:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Класифікація хімічних реакцій за кількістю і хімічним складом реагентів і продуктів.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції за кількістю і хімічним складом реагентів і продуктів.
| Реакція | |||||
| Схема | Реагенти | Продукти | Тип | ||
| Речовини | |||||
| 1 | Дві складні | Обміну | B | ||
| 2 | Дві складні | Одна складна | Сполучення | Д | |
| 3 | Складна й проста | Заміщення | A | ||
| 4 | Одна складна | Дві складні | Розкладання | Г | |
Відповідь: 1В, 2Д, 3А, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння класифікувати речовини за хімічним складом і властивостями.
| Речовина | |||||
| Формула | Хімічний склад | Назва | Природа | ||
| 1 | Бінарна сполука типового неметалічного елемента з Оксигеном, ступінь окиснення якого –2 | Сульфур(IV) оксид | Кислотний оксид | A | |
| 2 | Складна речовина, утворена катіонами лужного елемента й гідроксид-аніонами | Калій гідроксид | Луг | Г | |
| 3 | Складна речовина, утворена атомами Гідрогену, здатними до заміщення на атоми металічного елемента, і кислотним залишком | Сульфідна кислота | Двоосновна кислота | B | |
| 4 | Складна речовина, утворена катіонами металічного елемента й кислотним залишком | Натрій сульфіт | Сіль | Б | |
Відповідь: 1А, 2Г, 3В, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура органічних сполук.
Завдання скеровано на перевірку вміння інтерпретувати префікси в систематичних назвах органічних речовин з огляду на будову їхніх молекул.
| Формула речовини | Назва | Префікс | Значення префікса | ||
| 1 | 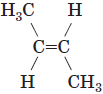 |
транс-бут-2-ен | транс- | Якщо кожен з атомів Карбону при зв’язку |
B |
| 2 | 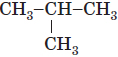 |
ізобутан | ізо- | Указує на розгалужену будову карбонового ланцюга | Д |
| 3 | 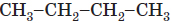 |
н-бутан | н- | Указує на лінійну будову карбонового ланцюга | A |
| 4 | 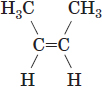 |
цис-бут-2-ен | цис- | Якщо кожен з атомів Карбону при зв’язку |
Б |
Відповідь: 1В, 2Д, 3А, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні класи органічних сполук.
Завдання скеровано на перевірку вміння класифікувати органічні речовини з огляду на будову їхніх молекул.
| Речовина | |||||
| Формула | Характеристична група | Назва | Природа | ||
| 1 | 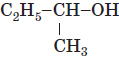 |
Гідроксильна |
Бутан-2-ол | спирт | B |
| 2 | 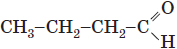 |
Альдегідна |
Бутаналь | альдегід | A |
| 3 | 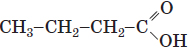 |
Карбоксильна |
Бутанова кислота | карбонова кислота | Д |
| 4 | 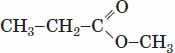 |
Естерна група |
Метилпропанат | естер | Г |
Відповідь: 1В, 2А, 3Д, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку вміння аналізувати й порівнювати будову атомів з огляду на місце хімічних елементів у періодичній системі.
Кількість електронів на зовнішньому енергетичному рівні визначають за номером групи хімічного елемента в короткоперіодній формі періодичної системи.
| Символ хімічного елемента | ||||
| Номер групи | VIIA | VIA | IIIA | IA |
| Кількість електронів на зовнішньому енергетичному рівні | 7 | 6 | 3 | 1 |
Відповідь: Г В Б А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни радіусів атомів хімічних елементів у групах і періодах періодичної системи.
Радіус атома – це відстань від центра його ядра до сферичної поверхні, на якій найчастіше трапляються електрони зовнішнього енергетичного рівня.
У періодах зі зростанням протонного числа радіус атомів зменшується.
У головних підгрупах зі зростанням протонного числа радіус атомів зростає (рис. 1).
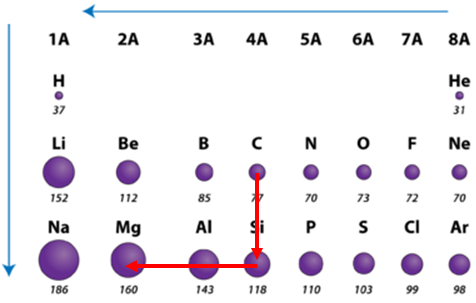
Рис. 1. Закономірності зміни радіусів атомів у періодах і групах періодичної системи
Відповідь: Г Б А В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Неорганічна хімія. Генетичні зв’язки між основними класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між основними класами неорганічних сполук.
Ланцюжок перетворень неметалу на кислу сіль такий:
1)
2)
3)
Відповідь: Г Б В А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Неорганічна хімія. Генетичні зв’язки між основними класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між основними класами неорганічних сполук.
Ланцюжок перетворень солі гідроксиду на сіль такий:
1)
2)
3)
Відповідь: Б В Г А.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Органічна хімія. Генетичні зв’язки між неорганічними й органічними сполуками.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними й органічними сполуками.
Ланцюжок перетворень неорганічної речовини на естер такий:
1)
2)
3)
Відповідь: Г А В Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між класами органічних сполук.
Ланцюжок перетворень дисахариду на альдегід такий:
1)
2)
3)
Відповідь: Г В А Б.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою окисника –
Відповідь: 10.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Номенклатура спиртів.
Завдання скеровано на перевірку вміння називати насичені ациклічні спирти за систематичною номенклатурою.
Називати насичені ациклічні спирти за систематичною номенклатурою потрібно за алгоритмом, наведеним на схемі (рис. 1).

Рис. 1. Алгоритм побудови назв насичених ациклічних спиртів за систематичною номенклатурою
Важливо пам’ятати:
- потрібно нумерувати карбоновий ланцюг із того кінця, до якого ближче розташована гідроксильна група;
- якщо гідроксильна група рівновіддалена від обох кінців головного карбонового ланцюга, то нумерують із того кінця, до якого ближче розташований алкільний замісник;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, то його нумерують так, щоб замісник, назву якого за абеткою вживають раніше, був позначений найменшим числом;
- якщо гідроксильна група й замісники рівновіддалені від обох кінців головного карбонового ланцюга, але з одного кінця замісників більше, то нумерацію проводять з урахуванням положення замісників, позначених найменшими числами.
Вибір головного ланцюга й нумерацію атомів Карбону в ньому за цим алгоритмом зображено на рисунку 2.
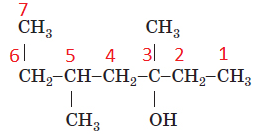
Рис. 2. Вибір головного ланцюга й нумерація атомів Карбону в ньому
У головному ланцюгу сім атомів Карбону, із третім атомом Карбону в ньому сполучено характеристичну гідроксильну групу
Назва спирту – 3,5-диметилгептан-3-ол.
Відповідь: 353.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами.
Завдання скеровано на перевірку вміння обчислювати молярну масу за формулою речовини.
Дано:
Знайти:
Відповідь: 234.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними формулами.
Завдання скеровано на перевірку вміння обчислювати об’єм газуватої речовини за її масою.
Дано:
Знайти:
Відповідь: 112.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Суміші. Обчислення кількісного складу суміші.
Завдання скеровано на перевірку вміння обчислювати кількісний склад суміші газів.
Дано:
Знайти:
Відповідь: 25.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати об’єм газуватого реагенту за відомим об’ємом газуватого продукту реакції.
Дано:
Знайти:
Відповідь: 18.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати масу продукту реакції за хімічним рівнянням, якщо один із реагентів узято в надлишку.
Дано:
Знайти:
За рівнянням реакції
Відповідь: 42.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 150.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями. Комбіновані задачі.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
За рівнянням реакції
Відповідь: 42.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння визначати формулу речовини за масами продуктів її згоряння і відносною густиною за іншим газом.
Дано:
Знайти:
Відповідь: 6.
Знайшли помилку? Пишіть на




