ЗНО онлайн 2011 року з хімії – основна сесія
Тестові завдання основної сесії ЗНО 2011 року з хімії
ТЕМА: Загальна хімія. Будова атома. Протонне число.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома хімічного елемента та його протонне число за місцем у періодичній системі.
П’ять електронів на зовнішньому енергетичному рівні міститься в атомах хімічних елементів VА групи. Умову завдання задовольняє елемент із протонним числом
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Нуклонне число. Кількість нейтронів у нукліді.
Завдання скеровано на перевірку вміння визначати склад атомних ядер.
| Нуклідний символ | Протонне число, зарядове число, порядковий номер, |
Масове або нуклонне число, |
Нейтронне число, |
| 7 | 13 | 6 |
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів хімічних елементів.
Формула вищого оксиду
Умову завдання задовольняє електронна формула атома Алюмінію
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати будову атома хімічного елемента.
В атомі
Молярна маса його гідроксиду становить
Тобто йдеться про Кальцій, його порядковий номер у періодичній системі хімічних елементів і, відповідно, протонне число дорівнює
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Структура періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння розрізняти малі й великі періоди.
Періодична система хімічних елементів – це графічний вираз періодичного закону. Нині в періодичній системі
Періодом називають фрагмент природного ряду хімічних елементів, у якому вони розташовані переважно за зростанням атомних мас. Кожен період починається лужним і завершується інертним елементом.
Перший, другий і третій періоди називають малими. У першому періоді – два елементи, у другому й третьому – по вісім. Ці періоди (короткоперіодна форма періодичної системи) містять по одному ряду хімічних елементів.
Умову завдання задовольняє добірка елементів третього періоду
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Закономірності періодичної системи хімічних елементів.
Завдання скеровано на перевірку вміння аналізувати будову атома за місцем хімічного елемента в періодичній системі.
В атомах хімічних елементів другого періоду послідовно збільшуються номери груп, до яких вони належать, і, відповідно, кількість електронів на зовнішньому енергетичному рівні їхніх атомів.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Електронні орбіталі. Форма електронних хмар.
Завдання скеровано на перевірку вміння розпізнати електронні хмари за формою.
У молекулі гідроген броміду хімічний зв’язок між атомами утворюється внаслідок перекривання кулястої 1s-електронної хмари атома Гідрогену й гантелеподібної 4p-електронної хмари атома Брому.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічний зв’язок. Йонний зв’язок.
Завдання скеровано на перевірку вміння аналізувати хімічну формулу й визначати тип хімічного зв’язку в речовині.
Хімічним зв’язком називають сили, які утримують атоми в молекулах або кристалах. Зв’язок між йонами називають йонним.
У кальцій броміді йонний зв’язок утворюється внаслідок переходу двох електронів зовнішнього енергетичного рівня атома Кальцію до атомів Брому (рис. 1).
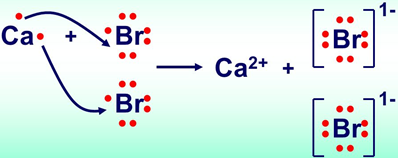
Рис. 1. Утворення йонного зв’язку в кальцій бромід
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів у речовинах.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Брому більша за електронегативність Гідрогену, Літію, Кальцію, Алюмінію (рис. 1).
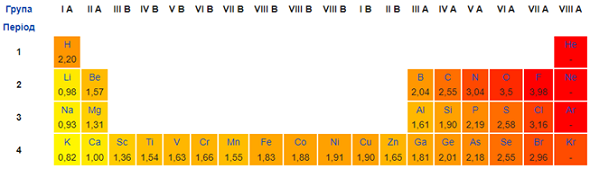
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Тому в бінарних сполуках із ними його ступінь окиснення негативний. Найбільша кількість електронів на зовнішньому енергетичному рівні в атома Алюмінію. Тому ступінь окиснення в бінарній сполуці із Бромом буде вищим порівняно з іншими елементами, про які йдеться в завданні:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Солі.
Завдання скеровано на перевірку вміння класифікувати солі.
Формула питної соди
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Кристалічні ґратки.
Завдання скеровано на перевірку вміння визначати тип кристалічних ґраток у речовині.
Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: атомні, молекулярні, йонні.
Карборунд – бінарна сполука неметалічних елементів, міцні зв’язки між атомами яких ковалентні. Кристалічні ґратки в карборунді атомні, тому це дуже міцний і твердий матеріал.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Нітрати.
Завдання скеровано на перевірку вміння складати й інтерпретувати рівняння реакцій термічного розкладання нітратів.
Продукти термічного розкладання нітратів залежно від положення металу в ряду активності наведено на рисунку 1.
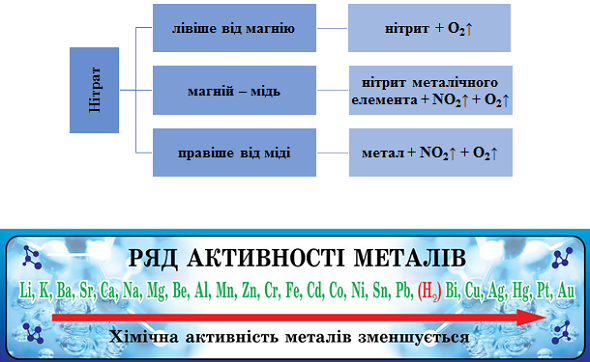
Рис. 1. Продукти термічного розкладання нітратів залежно від положення металу в ряду активності
Сума коефіцієнтів рівняння термічного розкладання аргентум(I) нітрату дорівнює
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Білки.
Завдання скеровано на перевірку вміння розпізнавати білки.
Етен – вуглеводень.
Триолеїн – жир.
Гемоглобін – білок.
Глікоген – вуглевод.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Основні поняття органічної хімії. Первинні, вторинні, третинні атоми Карбону.
Завдання скеровано на перевірку вміння розрізняти первинні, вторинні, третинні атоми Карбону.
Атоми Карбону в органічних сполуках поділяють на:
- первинні – сполучені з одним Карбоном,
- вторинні – сполучені з двома атомами Карбону,
- третинні – сполучені з трьома атомами Карбону,
- четвертинні – сполучені з чотирма атомами Карбону.
Вторинний атом Карбону позначено буквою A.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Властивості і фізіологічна дія неорганічних й органічних речовин.
Завдання скеровано на перевірку знання фізіологічної дії деяких неорганічних й органічних речовин.
Кальцій оксид – їдка речовина, взаємодіє з вологою шкіри й слизових із утворенням їдкого лугу – кальцій гідроксиду. Тому кальцій оксид спричиняє хімічний опік шкіри.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Типи реакцій в органічній хімії.
Завдання скеровано на перевірку знання типів реакцій за участі органічних речовин.
1. Гідролізом хлороетану добувають етанол:
2. Дегідратацією етанолу добувають етен:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Суміші. Способи розділення сумішей.
Завдання скеровано на перевірку вміння добирати спосіб розділення суміші з огляду на її склад.
Для вилучення з води завислих частинок дрібного вугілля потрібно використати фільтрування.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку знання генетичних зв’язків між класами органічних сполук.
1. Гідролізом хлороетану добувають етанол
2. Окисненням етанолу добувають етаналь
3. Окисненням етаналю добувають етанову кислоту
4.Естерифікацією етанової кислоти добувають метилетаноат
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Сірка. Окисно-відновні реакції.
Завдання скеровано на перевірку знання хімічних властивостей сірки й уміння аналізувати реакції за її участі з погляду окиснення-відновлення.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Сульфуру більша за електронегативність Гідрогену, Натрію і Феруму, менша за електронегативність Оксигену. Тож сірка виявлятиме відновні властивості в реакції з киснем:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Електроліти. Електролітична дисоціація.
Завдання скеровано на перевірку вміння прогнозувати продукти електролітичної дисоціації.
У водному розчині з утворенням катіонів Гідрогену дисоціюють сульфатна кислота (1), гідроген бромід (2), сульфітна кислота (5).
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні речовини. Амоніак.
Завдання скеровано на перевірку знання способів добування неорганічних речовин.
У промисловості з двох простих речовин синтезують амоніак:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна рівновага та умови її зміщення.
Завдання скеровано на перевірку вміння прогнозувати зміщення хімічної рівноваги під впливом різних чинників.
Ця реакція ендотермічна, відбувається без зміни об’єму. Тому з-поміж наведених варіантів зміщенню рівноваги в бік утворення карбон(IV) оксиду сприятиме зниження концентрації водню.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
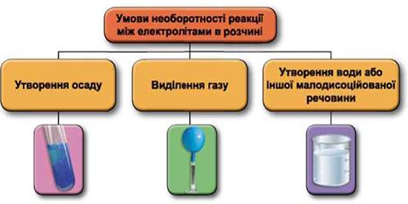
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція нейтралізації між лугом і кислотою:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Алкани.
Завдання скеровано на перевірку знання хімічних властивостей алканів.
Для етану як представника алканів характерні реакції повного окиснення та заміщення.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Амоніак. Класифікація хімічних реакцій.
Завдання скеровано на перевірку знання хімічних властивостей амоніаку й уміння класифікувати хімічні реакції.
Амоніак і гідроген бромід вступають у реакцію сполучення з утворенням солі – амоній броміду:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Металічні елементи. Ферум.
Завдання скеровано на перевірку знання хімічних властивостей заліза і сполук Феруму та вміння аналізувати з погляду окиснення-відновлення реакції за їхньої участі.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Умову завдання задовольняє реакція між ферум(ІІ) хлоридом і хлором з утворенням ферум(ІІІ) хлориду:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи. Крохмаль.
Завдання скеровано на перевірку знання хімічних властивостей крохмалю.
Кінцевим продуктом гідролізу крохмалю є глюкоза.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна рівновага та умови її зміщення.
Завдання скеровано на перевірку вміння прогнозувати зміщення хімічної рівноваги під впливом різних чинників.
Загальний принцип зміщення хімічної рівноваги полягає в тому, що система, яка перебуває в стані стійкої хімічної рівноваги, під зовнішнім впливом (зміною температури, тиску, умісту реагентів і продуктів реакції тощо) прагне повернутися до стану рівноваги, компенсувавши дію впливу.
Серед наведених варіантів умову завдання задовольняє реакція
Ця реакція відбувається зі збільшенням об’єму. Тому підвищення тиску приведе до зміщення хімічної рівноваги в бік утворення реагенту.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Карбон(IV) оксид.
Завдання скеровано на перевірку знання способів добування карбон(IV) оксиду.
Карбон(IV) оксид добувають дією хлоридної кислоти на мармур, головним складником якого є кальцій карбонат:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічні й органічні речовини, їхні властивості.
Завдання скеровано на перевірку знання властивостей водню, азоту, кисню, метану, бутану, гідроген хлориду, амоніаку, розуміння умов збирання газів витісненням води.
Витісненням води збирають газуваті мало- або нерозчинні у воді речовини, які не реагують із нею (рис. 1).
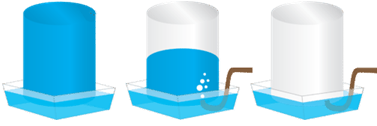
Рис. 1. Збирання газу витісненням води
Із-поміж наведених у завданні речовин добре розчинними є гідроген хлорид й амоніак. Тому їх не збирають витісненням води.
Тож умову завдання задовольняє варіант відповіді метан, кисень, азот, адже ці гази малорозчинні у воді.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Кислотні оксиди. Кислоти. Кислотні опади.
Завдання скеровано на перевірку знання причин і наслідків кислотних опадів.
Унаслідок згоряння палива в повітря потрапляють кислотні оксиди – сульфур(ІV) оксид, вуглекислий газ, нітроген(ІV) оксид. Вони реагують з атмосферною вологою. Це призводить до утворення кислотних опадів.
Серед наведених варіантів відповіді умову завдання задовольняють сульфур(ІV) оксид і нітроген(ІV) оксид:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Високомолекулярні органічні сполуки. Природні й синтетичні волокна.
Завдання скеровано на перевірку знання видів волокон.
Синтетичне волокно – капрон. Капрон можна розглядати як продукт внутрішньомолекулярних взаємодій карбоксильної групи й аміногрупи молекули 6-аміногексанової кислоти.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Металічні елементи. Метали. Ряд активності металів.
Завдання скеровано на перевірку вміння порівнювати активність металів за їхнім положенням у ряду активності.
Здатність середніх солей взаємодіяти в розчині з металами можна спрогнозувати за довідковою таблицею «Ряд активності металів» (рис. 1).

Рис. 1. Ряд активності металів
Що лівіше розташований метал у цьому ряду, то він активніший. Тобто витіснятиме з розчинів солей метали, розміщені правіше від нього.
Із-поміж металів, про які йдеться в умові завдання, найпасивнішою є мідь.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Вуглеводи. Крохмаль.
Завдання скеровано на перевірку знання якісної реакції на крохмаль.
Спиртовий розчин йоду – реактив на крохмаль, і навпаки. Поява синього забарвлення – ознака взаємодії крохмалю з йодом.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Арени.
Завдання скеровано на перевірку вміння розпізнавати структурні формули аренів.
Арени – вуглеводні, що містять принаймні одне ароматичне кільце – плоску циклічну структуру, де атоми Карбону сполучені між собою особливими хімічними зв’язками, проміжними за довжиною і деякими іншими характеристиками між подвійним (ненасиченим) і простим (насиченим). Інша назва аренів – ароматичні вуглеводні, а зв’язків у їхніх молекулах між атомами Карбону – ароматичні зв’язки. Загальна формула аренів –
Умову завдання задовольняє толуен
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома.
Кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп дорівнює номеру групи в періодичній системі хімічних елементів.
| Назва хімічного елемента | Номер групи (короткоперіодна форма періодичної системи) | Будова зовнішнього енергетичного рівня атома | ||
| 1 | Сульфур | VI | Д | |
| 2 | Хлор | VII | Б | |
| 3 | Калій | I | Г | |
| 4 | Кальцій | II | A |
Відповідь: 1Д, 2Б, 3Г, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні сполуки різних класів.
| Хімічна формула | Природа речовини | Опис | ||
| 1 | середня сіль | Складна речовина, утворена катіонами металічного елемента й аніонами кислотного залишку | Д | |
| 2 | основна сіль | Складна речовина, утворена катіонами металічного елемента, гідроксид-аніонами й аніонами кислотного залишку | A | |
| 3 | кислотний оксид | Бінарна сполука неметалічного елемента з Оксигеном, у якій ступінь оеиснення Оксигену дорівнює –2; вищий оксид неметалічного елемента | Б | |
| 4 | одноосновна кислота | Складна речовина, що містить атоми Гідрогену, здатні заміщуватися атомами металічного елемента, і кислотний залишок | B |
Відповідь: 1Д, 2А, 3Б, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна й неорганічна хімія. Основні класи неорганічних сполук.
Завдання скеровано на перевірку вміння розпізнавати неорганічні й органічні речовини за будовою їхніх молекул.
| Речовина | ||||
| Назва | Формула | Модель молекули | ||
| 1 | Метиловий спирт | 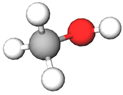 |
Д | |
| 2 | Етилен | 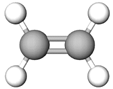 |
B | |
| 3 | Вода | 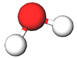 |
Б | |
| 4 | Оцтова кислота | 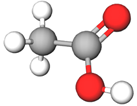 |
Г | |
Відповідь: 1Д, 2В, 3Б, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Кількість речовини. Молярна маса.
Завдання скеровано на перевірку розуміння взаємозв’язків між кількістю речовини та її масою.
Маса речовини дорівнює добутку її кількості на молярну масу:
| Речовина | |||||
| Формула | Молярна маса, г/моль | Кількість, моль | Маса (г) | ||
| 1 | 30 | 2 | 60 | Г | |
| 2 | 18 | 3 | 54 | A | |
| 3 | 56 | 0,25 | 14 | Д | |
| 4 | 17 | 4 | 68 | Б | |
Відповідь: 1Г, 2А, 3Д, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна й неорганічна хімія. Властивості неорганічних та органічних речовин.
Завдання скеровано на перевірку знання властивостей органічних та неорганічних речовин, уміння складати рівняння реакцій за їхньої участі.
| Рівняння реакції | ||
| 1 | B | |
| 2 | Д | |
| 3 | Б | |
| 4 | Г |
Відповідь: 1В, 2Д, 3Б, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними речовинами різних класів.
Відповідь: В А Б Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна та органічна хімія. Властивості неорганічних та органічних сполук.
Завдання скеровано на перевірку вміння аналізувати залежність властивостей речовин від хімічного складу й будови їхніх молекул.
Потрібно взяти до уваги, що етанова кислота сильніша за карбонатну, адже витісняє її з карбонатів.
Карбон(IV) оксид витісняє фенол з натрій феноляту, що доводить: фенол є слабшою кислотою порівняно з карбонатною.
Як фенол, так і етанол реагують з натрієм, однак з натрій гідроксидом фенол реагує, а етанол – ні. Тобто фенол виявляє сильніші порівняно з етанолом кислотні властивості.
Кислотні властивості сполук збільшуються в ряду

Відповідь: Б Г В А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Неорганічна хімія. Метали. Неметали.
Завдання скеровано на перевірку вміння складати й тлумачити рівняння реакцій між металами й неметалами.
| Хімічне рівняння | Сума коефіцієнтів | |
| 7 | Г | |
| 5 | B | |
| 4 | A | |
| 3 | Б |
Відповідь: Г В А Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Енергетичні рівні й підрівні.
Завдання скеровано на перевірку вміння визначати кількість енергетичних рівнів в електронній оболонці атомів.
Номер періоду, у якому міститься хімічний елемент, збігається з кількістю енергетичних рівнів у його електронній оболонці.
| Хімічний елемент | ||
| Символ | Номер періоду в періодичній системі | |
| 2 | Б | |
| 3 | A | |
| 4 | B | |
| 5 | Г | |
Відповідь: Б А В Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Енергетичні рівні й підрівні. Будова зовнішнього енергетичного рівня.
Завдання скеровано на перевірку вміння визначати кількість електронів на зовнішніх енергетичних рівнях атомів.
Номер групи (короткоперіодна форма періодичної системи хімічних елементів), у якій міститься хімічний елемент, збігається з кількістю електронів на зовнішньому енергетичному рівні його атома.
| Хімічний елемент | |||
| Назва | Номер групи в періодичній системі хімічних елементів (короткоперіодна форма) | Кількість електронів на зовнішньому енергетичному рівні атома | |
| Калій | IA | 1 | Г |
| Фосфор | VA | 5 | Б |
| Оксиген | VIA | 6 | B |
| Хлор | VIIA | 7 | A |
Відповідь: Г Б В А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
Відповідь: А Б Г В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Кількість речовини. Молярна маса.
Завдання скеровано на перевірку розуміння взаємозв’язків між кількістю речовини та її масою.
Кількість речовини дорівнює частці від ділення її маси на молярну масу:
За однакової маси кількість речовини в порції збільшується зі зменшенням молярної маси. Тобто розв’язання завдання полягає в розташуванні формул речовин за зменшенням їхніх молярних мас.
| Формула | Молярна маса, г/моль | |
| 160 | B | |
| 96 | Б | |
| 64 | A | |
| 32 | Г |
Відповідь: В Б А Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Закономірності періодичної системи хімічних елементів. Електронегативність.
Завдання скеровано на перевірку розуміння закономірностей зміни електронегативності й окиснювальних властивостей хімічних елементів у періодах і групах (рис. 1).
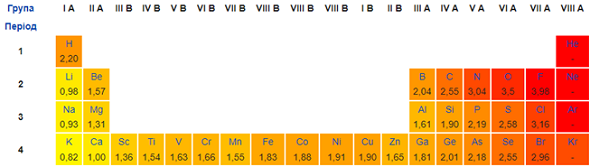
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Відповідь: Г Б А В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Відносна густина газу.
Завдання скеровано на перевірку розуміння поняття відносної густини газу.
Відносна густина
Тобто густина газу то більша, що більша його молекулярна маса.
| Газ | |||
| Назва | Хімічна формула | Відносна молекулярна маса | |
| Метан | 16 | A | |
| Карбон(II) оксид | 28 | B | |
| Кисень | 32 | Б | |
| Гідроген сульфід | 34 | Г | |
Відповідь: А В Б Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
Відповідь: В А Б Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Неметали. Озон. Хлор.
Завдання скеровано на перевірку знання галузей застосування неметалів.
Найпоширенішими дезінфектантами води на водопровідних станціях є хлор й озон. Протонні числа Хлору й Оксигену –
Відповідь: 25.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями об’єму газуватого реагенту за відомим об’ємом іншого газуватого реагенту.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням об’єму газуватого реагенту за відомим об’ємом іншого газуватого реагенту.
Дано:
Знайти:
Відповідь: 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою відновника –
Відповідь: 3.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Визначення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 20.
Знайшли помилку? Пишіть на
ТЕМА: Розчини. Солі. Кристалогідрати.
Завдання скеровано на перевірку вміння обчислювати масу кристалогідрату, використаного для приготування розчину.
Дано:
Знайти:
Відповідь: 143.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Комбіновані задачі. Визначення складу суміші.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
Відповідь: 10.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення відносного виходу продукту реакції.
Завдання скеровано на перевірку вміння обчислювати відносний вихід продукту реакції.
Дано:
Знайти:
Відповідь: 80.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Солі. Кристалогідрати.
Завдання скеровано на перевірку вміння обчислювати масу кристалізаційної води в кристалогідраті.
Дано:
Знайти:
Відповідь: 18.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Визначення формули речовини за відношенням мас хімічних елементів у ній.
Завдання скеровано на перевірку вміння визначати формулу речовини за відношенням мас хімічних елементів у ній.
Дано:
Знайти:
Відповідь: 20.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями. Комбіновані задачі.
Завдання скеровано на перевірку вміння розв’язувати комбіновані задачі.
Дано:
Знайти:
За рівнянням реакції
Відповідь: 80.
Знайшли помилку? Пишіть на




