ЗНО онлайн 2010 року з хімії – основна сесія
Тестові завдання основної сесії ЗНО 2010 року з хімії
ТЕМА: Будова атома. Протонне число.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома хімічного елемента та його протонне число за місцем у періодичній системі.
Два електрони на зовнішньому енергетичному рівні міститься в атомах хімічних елементів IIА групи. Умову завдання задовольняє елемент із протонним числом
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Нуклонне число. Кількість нейтронів у нукліді.
Завдання скеровано на перевірку вміння визначати склад атомних ядер.
| Нуклідний символ | Протонне число, зарядове число, порядковий номер, |
Масове або нуклонне число, |
Нейтронне число, |
| 35 | 80 | 45 |
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння аналізувати електронні формули атомів хімічних елементів.
Формула вищого оксиду
Умову завдання задовольняє електронна формула атома Карбону
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома.
Завдання скеровано на перевірку вміння визначати будову атома хімічного елемента.
Формула вищого оксиду елемента ІV групи –
Тобто йдеться про Титан, його порядковий номер у періодичній системі хімічних елементів і, відповідно, протонне число дорівнює
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Структура періодичної системи хімічних елементів.
Завдання скеровано на перевірку знання структури періодичної системи й уміння аналізувати її.
До тої самої підгрупи VIA (у довгоперіодному варіанті періодичної системи це група 16) належать Оксиген, Сульфур, Телур.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Структура періодичної системи хімічних елементів. Закономірності зміни властивостей хімічних елементів залежно від місця в періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у періодах періодичної системи хімічних елементів.
У малих періодах зі збільшенням протонного числа збільшується від
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Електронні орбіталі. Форма електронних хмар.
Завдання скеровано на перевірку вміння розпізнати електронні хмари за формою.
У молекулі гідроген хлориду хімічний зв’язок утворюється внаслідок усуспільнення пари електронів атомами Гідрогену й Хлору. В утворенні хімічного зв’язку беруть участь неспарені електрони зовнішніх енергетичних рівнів:
У молекулі хімічний зв’язок між атомами утворюється внаслідок перекривання 1s-електронної хмари атома Гідрогену та 3p-електронної хмари атома Хлору (рис. 1).
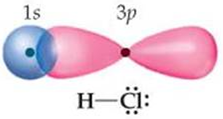
Рис. 1. Перекривання електронних хмар атомів у молекулі гідроген хлориду
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічний зв’язок. Йонний зв’язок.
Завдання скеровано на перевірку вміння визначати тип хімічного зв`язку в сполуці за її формулою.
Умову завдання потрібно переформулювати: визначте тип хімічного зв’язку в сполуці, утвореній хімічними елементами з порядковими номерами
У кальцій броміді йонний зв’язок утворюється внаслідок переходу двох електронів зовнішнього енергетичного рівня атома Кальцію до атомів Брому (рис. 1).
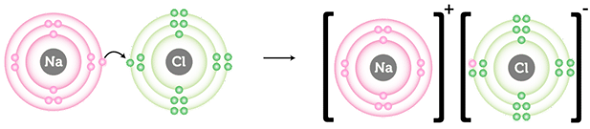
Рис. 1. Утворення йонного зв’язку в натрій хлориді
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів у речовинах.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Нітрогену більша за електронегативність Гідрогену, Літію, Кальцію, Алюмінію (рис. 1).
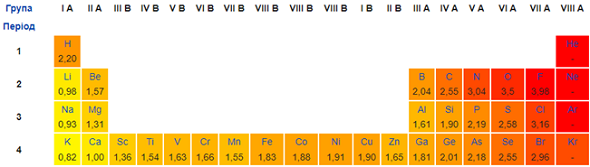
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Тому в бінарних сполуках із ними його ступінь окиснення негативний. Найбільша кількість електронів на зовнішньому енергетичному рівні в атома Алюмінію. Тому ступінь окиснення в бінарній сполуці з Нітрогеном буде вищим порівняно з іншими елементами, про які йдеться в завданні:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів у речовинах.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Карбон – хімічний елемент IVА підгрупи, у його атомі на зовнішньому енергетичному рівні чотири електрони. Тож максимальний ступінь окиснення
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Сульфур. Сполуки Сульфуру.
Завдання скеровано на перевірку знання фізичних і хімічних властивостей сполук Сульфуру.
Умову завдання задовольняє гідроген сульфід
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Кристалічні ґратки.
Завдання скеровано на перевірку вміння прогнозувати тип кристалічних ґраток у речовині за її фізичними властивостями.
Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток і сили взаємодії між частинками визначають тип ґраток: атомні, молекулярні, йонні.
Молекулярні кристалічні ґратки побудовані з молекул речовини. Зазвичай у таких речовин низькі температури плавлення й кипіння, адже молекули слабко зв’язані між собою. Молекулярні ґратки мають у твердому стані водень
Умову завдання задовольняють молекулярні кристалічні ґратки.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Карбон. Карбонати й гідрогенкарбонати.
Завдання скеровано на перевірку вміння складати рівняння реакцій за участі неорганічних речовин.
Харчова сода – тривіальна назва натрій гідрогенкарбонату – сіль слабкої карбонатної кислоти. Під дією оцтової (етанової), яка сильніша за карбонатну, відбувається реакція:
Сума коефіцієнтів у цьому хімічному рівняння –
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Білки.
Завдання скеровано на перевірку знання поширеності білків у природі.
Білкову природу мають шкіра, волосся, гемоглобін.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки. Карбонові кислоти.
Завдання скеровано на перевірку знання застосування представників карбонових кислот.
Умову завдання задовольняє оцтова (етанова) кислота.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Органічна хімія. Фізіологічна дія деяких неорганічних й органічних речовин.
Завдання скеровано на перевірку знання фізіологічної дії деяких неорганічних й органічних речовин.
Умову завдання задовольняє натрій гідроксид – їдка речовина – складник засобу для прочищення каналізаційних труб.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними сполуками.
Умову завдання задовольняє карбон(IV) оксид:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук. Оксигеновмісні органічні сполуки. Спирти.
Завдання скеровано на перевірку вміння розпізнавати спирти за їхніми хімічними властивостями.
Умову завдання задовольняють спирти:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними сполуками.
Умову завдання задовольняє етин:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Сірка.
Завдання скеровано на перевірку знання хімічних властивостей сірки й уміння визначати ступені окиснення хімічних елементів за формулами речовин, окисники й відновники у хімічних реакціях.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Під час окиснення окисник приймає електрони й відновлюється, а відновник віддає електрони й окиснюється.
A
Б
B
Г
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електроліти. Електролітична дисоціація. Неорганічна хімія. Сполуки неметалічних елементів.
Завдання скеровано на перевірку вміння прогнозувати продукти електролітичної дисоціації речовин.
Умову завдання задовольняють сульфідна кислота (1), гідроген бромід (2), сульфітна кислота (5).
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Сполуки неметалічних елементів. Амоніак.
Завдання скеровано на перевірку знання способів добування деяких неорганічних речовин.
Умову завдання задовольняє амоніак, який у промисловості синтезують з азоту й водню:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна рівновага та умови її зміщення.
Завдання скеровано на перевірку вміння прогнозувати зміщення хімічної рівноваги під впливом різних чинників.
Для розв’язання завдання потрібно застосувати загальний принцип зміщення хімічної рівноваги, сформульований Ле Шательє. Принцип полягає в тому, що система, яка перебуває в стані стійкої хімічної рівноваги, під зовнішнім впливом (зміною температури, тиску, концентрації реагентів і продуктів реакції тощо) прагне повернутися до стану рівноваги, компенсувавши дію впливу.
для зміщення хімічної рівноваги в бік утворення амоніаку потрібно збільшити концентрацію амоній хлориду. На протидію цьому рівновага в системі зміститься в бік утворення амоніаку.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Алкани.
Завдання скеровано на перевірку знання хімічних властивостей алканів і вміння класифікувати реакції за їхньої участі.
Для всіх алканів характерні реакції повного окиснення і заміщення, у реакції ізомеризації вступають алкани, у молекулах яких не менше чотирьох атомів Карбону.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електролітична дисоціація. Реакції йонного обміну між електролітами в розчині.
Завдання скеровано на перевірку вміння перетворювати скорочені йонні рівняння на молекулярні.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. За умовою завдання мають прореагувати дві розчинні сполуки, одна з яких дисоціює з утворенням катіона Алюмінію, а друга – з утворенням гідроксид-аніона. Умову завдання задовольняють алюміній нітрат і калій гідроксид:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Основні класи неорганічних сполук. Класифікація хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції між неорганічними сполуками.
Хімічна реакція між калій гідроксидом і нітратною кислотою – це реакція між двома складними речовинами – лугом і кислотою – з утворенням двох складних речовин – солі й води:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Металічні елементи. Ферум.
Завдання скеровано на перевірку знання хімічних властивостей заліза і сполук Феруму та вміння аналізувати з погляду окиснення-відновлення реакції за їхньої участі.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Умову завдання задовольняє реакція між ферум(ІІ) хлоридом і хлором з утворенням ферум(ІІІ) хлориду:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи. Глюкоза.
Завдання скеровано на перевірку розуміння перетворення глюкози в організмах.
Кінцевими продуктами реакції окиснення глюкози в клітинах організмів є карбон (ІV) оксид і вода.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна рівновага та умови її зміщення.
Завдання скеровано на перевірку вміння прогнозувати зміщення хімічної рівноваги під впливом різних чинників.
Загальний принцип зміщення хімічної рівноваги полягає в тому, що система, яка перебуває в стані стійкої хімічної рівноваги, під зовнішнім впливом (зміною температури, тиску, умісту реагентів і продуктів реакції тощо) прагне повернутися до стану рівноваги, компенсувавши дію впливу.
Серед наведених варіантів умову завдання задовольняє реакція
Вона відбувається зі зменшенням об’єму. Тому підвищення тиску приведе до зміщення хімічної рівноваги в бік утворення продукту.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Хімічна рівновага та умови її зміщення.
Завдання скеровано на перевірку знання лабораторних способів добування кисню.
У лабораторії кисень добувають розкладанням гідроген пероксиду, калій перманганату, натрій нітрату:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводи. Гліцерол.
Завдання скеровано на перевірку знання застосування похідних гліцеролу.
Для виробництва вибухівки (динаміту) і судинорозширювальних ліків використовують гліцеролу тринітрат.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Природні джерела вуглеводнів. Переробка вуглеводневої сировини.
Завдання скеровано на перевірку знання екологічних проблем, безпосередньо зумовлених видобуванням, переробленням і використанням вуглеводневої сировини.
Парниковий ефект, фотохімічний смог і кислотні дощі є наслідками видобування, перероблення і використання вуглеводневої сировини.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Високомолекулярні органічні сполуки. Поліетилен.
Завдання скеровано на перевірку знання екологічних проблем, безпосередньо зумовлених використанням синтетичних полімерів.
Умову завдання задовольняє поліетилен.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Металічні елементи. Корозія металів і способи захисту від неї.
Завдання скеровано на перевірку знання способів захисту металів від корозії.
Лудіння – покриття металевих предметів (переважно, сталевих і мідних) шаром олова методом напилювання, електролізу або зануренням у розплавлене олово; захищає від корозії.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електроліз. Застосування електролізу.
Завдання скеровано на перевірку знання застосування електролізу.
Гальванопластика – формотворення з кольорового металу за допомогою осадження його з розчину (розтопу) під дією електричного струму на матриці. Після припинення електролізу восковий зліпок відділяють від шару металу і в результаті мають точну копію виробу.
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома.
Кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп дорівнює номеру групи в періодичній системі хімічних елементів. В атомах елементів побічних підгруп на зовнішньому енергетичному рівні два (зрідка – один) електрони, оскільки в них добудовується внутрішній d-підрівень.
| Назва хімічного елемента | Номер групи (короткоперіодна форма періодичної системи) | Будова зовнішнього енергетичного рівня атома | ||
| 1 | Молібден | VI Б | Д | |
| 2 | Арсен | V А | A | |
| 3 | Манган | VІI Б | Г | |
| 4 | Йод | VІІ А | B |
Відповідь: 1Д, 2А, 3Г, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Типи хімічних реакцій.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
| Хімічне рівняння | Склад і кількість реагентів і продуктів реакції | Реакція | ||
| 1 | І реагенти, і продукти реакції – дві складні речовини | обміну | B | |
| 2 | І реагенти, і продукти реакції – проста та складна речовини | заміщення | A | |
| 3 | Реагенти – дві складні речовини, продукт – одна складна речовина | сполучення | Б | |
| 4 | Реагент – одна складна речовина, продукти – дві складні речовини | розкладання | Г |
Відповідь: 1В, 2А, 3Б, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Застосування органічних і неорганічних речовин.
Завдання скеровано на перевірку вміння класифікувати хімічні реакції.
| Хімічна форула | Застосування речовини | ||
| 1 | Поліконденсацією 6-аміногексанової кислоти можна добути капрон | Д | |
| 2 | Натрій стеарат – мило | B | |
| 3 | Натрій флуорид, сіль, антикарієсна добавка до зубних паст | A | |
| 4 | Калій хлорид, сіль, катіони Калію і хлорид-аніони беруть участь у регулюванні водно-сольового обміну | Б |
Відповідь: 1Д, 2В, 3А, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Кількість речовини. Молярна маса.
Завдання скеровано на перевірку розуміння взаємозв’язків між кількістю речовини та її масою.
Маса речовини дорівнює добутку її кількості на молярну масу:
| Речовина | |||||
| Формула | Молярна маса, г/моль | Кількість, моль | Маса (г) | ||
| 1 | 40 | 1,5 | 60 | Б | |
| 2 | 32 | 0,5 | 16 | A | |
| 3 | 18 | 2 | 36 | Г | |
| 4 | 100 | 5 | 500 | B | |
Відповідь: 1Б, 2А, 3Г, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Нітрати.
Завдання скеровано на перевірку вміння складати й інтерпретувати рівняння реакцій термічного розкладання нітратів.
Продукти термічного розкладання нітратів залежно від положення металу в ряду активності наведено на рисунку 1.

Рис. 1. Продукти термічного розкладання нітратів залежно від положення металу в ряду активності
Продуктами термічного розкладання амоній нітрату є нітроген(І) оксид і вода.
Відповідь: 1А, 2В, 3Б, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними речовинами різних класів.
Відповідь: В Б А Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Металічні елементи. Оксиди металічних елементів.
Завдання скеровано на перевірку знання зміни хімічних властивостей оксидів залежно від місця відповідних хімічних елементів у періодичній системі.
Металічні властивості хімічних елементів у групах збільшуються зі збільшенням їхніх протонних чисел. Так само зростає активність їхніх оксидів у реакції з водою.
Відповідь: В А Г Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Неорганічна хімія. Метали. Неметали.
Завдання скеровано на перевірку вміння складати й тлумачити рівняння реакцій між металами й неметалами.
| Хімічне рівняння | Сума коефіцієнтів | |
| 3 | Г | |
| 4 | Б | |
| 5 | A | |
| 9 | B |
Відповідь: Г Б А В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодична система хімічних елементів. Протонне число.
Завдання скеровано на перевірку вміння визначати протонне число хімічного елемента за його місцем у періодичній системі.
Протонне число хімічного елемента дорівнює порядковому номеру елемента в періодичній системі.
| Символ хімічного елемента | Порядковий номер у періодичній системі | Протонне число | |
| B | 7 | ||
| Б | 20 | ||
| Г | 25 | ||
| A | 34 | ||
Відповідь: В Б Г А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Енергетичні рівні й підрівні.
Завдання скеровано на перевірку вміння визначати кількість енергетичних рівнів в електронній оболонці атомів.
Номер періоду, у якому міститься хімічний елемент, збігається з кількістю енергетичних рівнів у його електронній оболонці.
| Хімічний елемент | ||
| Символ | Номер періоду | |
| 2 | Г | |
| 3 | A | |
| 4 | Б | |
| 5 | B | |
Відповідь: Г А Б В.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
Відповідь: Б В Г А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Кількість речовини. Молярна маса.
Завдання скеровано на перевірку розуміння взаємозв’язків між кількістю речовини та її масою.
Кількість речовини дорівнює частці від ділення її маси на молярну масу:
За однакової маси кількість речовини в порції збільшується зі зменшенням молярної маси. Тобто розв’язання завдання полягає в розташуванні формул речовин за зменшенням їхніх молярних мас.
| Формула | Молярна маса, г/моль | |
| 80 | B | |
| 64 | A | |
| 48 | Б | |
| 16 | Г |
Відповідь: В А Б Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Алкани. Нафта. Детонаційна стійкість.
Завдання скеровано на перевірку розуміння залежності детонаційної стійкості алканів від будови їхніх молекул, суті фракційної перегонки нафти.
Детонаційна стійкість характеризує здатність вуглеводнів протистояти самозайманню за стискання. Зі збільшенням розгалуженості карбонового ланцюга підвищується детонаційна стійкість алканів.
За стандарт у шкалі детонаційної стійкості вибрано гептан нерозгалуженої будови й 2,2,4-триметилпентан – один з ізомерів октану. Суміш пари гептану з повітрям унаслідок сильного стиснення легко детонує, тож якість гептану як палива прийнято за нуль. Унаслідок розгалуженості карбонового ланцюга ізооктан стійкий до детонації, тому його якість як палива узято за
Відповідь: Г Б А В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Відносна молекулярна маса.
Завдання скеровано на перевірку вміння обчислювати відносну молекулярну масу й порівнювати склад вуглеводнів різних гомологічних рядів.
Послідовність розташування за збільшенням молекулярної маси очевидна з хімічних формул вуглеводнів.
| Вуглеводень | |||
| Назва | Молекулярна формула | Відносна молекулярна маса | |
| пропан | 44 | A | |
| бутен | 56 | B | |
| пентин | 68 | Г | |
| гексин | 82 | Б | |
Відповідь: А В Г Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
Відповідь: А Б Г В.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями об’єму газуватого реагенту за відомим об’ємом іншого газуватого реагенту.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням об’єму газуватого реагенту за відомим об’ємом іншого газуватого реагенту.
Дано:
Знайти:
Відповідь: 30.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Коефіцієнт перед формулою відновника –
Відповідь: 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Визначення масової частки розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масову частку розчиненої речовини.
Дано:
Знайти:
Відповідь: 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Розрахунки за хімічними формулами.
Завдання скеровано на перевірку вміння обчислювати масу речовини за кількістю речовини елемента в ній.
Дано:
Знайти:
Відповідь: 18.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями об’єму газуватого реагенту за відомим об’ємом іншого газуватого реагенту, що містить домішки.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням об’єму газуватого реагенту за відомим об’ємом іншого газуватого реагенту, що містить домішки.
Дано:
Знайти:
Відповідь: 14.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення відносного виходу продукту реакції.
Завдання скеровано на перевірку вміння обчислювати відносний вихід продукту реакції.
Дано:
Знайти:
Відповідь: 80.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Солі. Кристалогідрати.
Завдання скеровано на перевірку вміння обчислювати масову частку кристалізаційної води в кристалогідраті.
Дано:
Знайти:
Відповідь: 36.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення за термохімічними рівняннями.
Завдання скеровано на перевірку вміння обчислювати тепловий ефект хімічної реакції.
Дано:
Знайти:
Відповідь: 698.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Визначення молекулярної формули речовини за масовими частками хімічних елементів у ній і молярною масою.
Завдання скеровано на перевірку вміння визначати найпростішу формулу речовини за масовими частками хімічних елементів у ній і молярною масою.
Дано:
Знайти:
Відповідь: 31.
Знайшли помилку? Пишіть на
ТЕМА: Будова атома. Електронні формули атомів, йонів.
Завдання скеровано на перевірку вміння складати електронні формули атомів, йонів.
У катіоні
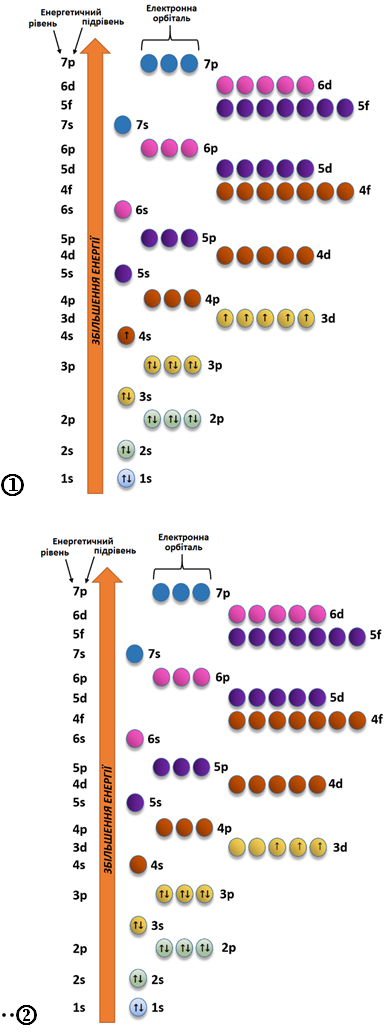
Рис. 1. Електронна будова атома Хрому (1) і катіона
Відповідь: 9.
Знайшли помилку? Пишіть на




