ЗНО онлайн 2010 року з хімії – пробний тест
Тестові завдання пробного тесту ЗНО 2010 року з хімії
ТЕМА: Будова атома. Протонне число.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома хімічного елемента та його протонне число за місцем у періодичній системі.
Три електрони на зовнішньому енергетичному рівні міститься в атомах хімічних елементів IIІА групи. Умову завдання задовольняє елемент із протонним числом
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Нуклонне число. Кількість нейтронів у нукліді. Ізотопи.
Завдання скеровано на перевірку розуміння суті ізотопії.
Ізотопами називають нукліди з однаковим атомним, але рiзними масовими числами, тобто з однаковою кількістю протонiв, але рiзною – нейтронiв.
Протій і Дейтерій є ізотопами Гідрогену, оскільки це нукліди того самого хімічного елемента:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Періодичний закон і періодична система хімічних елементів. Структура періодичної системи.
Завдання скеровано на перевірку вміння використовувати періодичну систему для складання формул найважливіших сполук хімічних елементів.
Елемент № 20 Кальцій належить до ІІА групи, формула його вищого оксиду
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Кількість енергетичних рівнів в атомі.
Завдання скеровано на перевірку вміння визначати кількість енергетичних рівнів в атомі за його місцем у періодичній системі.
Кількість енергетичних рівнів, на яких містяться електрони в атомі, визначають за номером періоду, у якому розташований хімічний елемент у періодичній системі.
Протонне число хімічного елемента дорівнює його порядковому номеру в періодичній системі.
Тобто потрібно визначити пару хімічних елементів того самого періоду. З-поміж наведених це елементи з протонними числами
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Кількість електронів на зовнішньому енергетичному рівні в атомі.
Завдання скеровано на перевірку вміння визначати кількість електронів на зовнішньому енергетичному рівні в атомі.
Кількість електронів на зовнішньому енергетичному рівні в атомі, визначають за номером групи (короткоперіодна форма періодичної системи), у якій розташований хімічний елемент у періодичній системі.
Протонне число хімічного елемента дорівнює його порядковому номеру в періодичній системі.
Тобто потрібно визначити пару хімічних елементів тієї самої групи. З-поміж наведених це елементи з протонними числами
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічний зв’язок. Йонний зв’язок.
Завдання скеровано на перевірку вміння визначати тип хімічного зв’язку в сполуці за її формулою.
Умову завдання задовольняє варіант відповіді калій бромід. Калій – типовий металічний елемент, Бром – типовий неметалічний. Електрон із зовнішнього енергетичного рівня атома Калію переходить на зовнішній енергетичний рівень атома Брому. Утворюються катіон Калію й аніон Брому (рис. 1).

Рис. 1. Утворення йонного зв’язку в калій броміді
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічний зв’язок. Ковалентний неполярний зв’язок.
Завдання скеровано на перевірку вміння визначати тип хімічного зв’язку в сполуці за її формулою.
Хімічним зв’язком називають сили, які утримують атоми в молекулах або кристалах.
Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку з вісьмох електронів.
Зв’язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул.
Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільної електронної пари розподілений між ними порівну. Такий зв’язок називають ковалентним неполярним.
Умову завдання задовольняє водень, формула якого
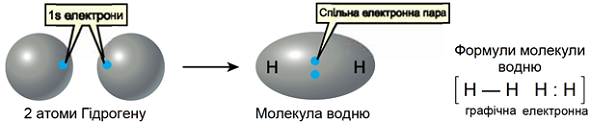
Рис. 1. Зображення ковалентного зв’язку в молекулі водню
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Ступінь окиснення. Нітроген.
Завдання скеровано на перевірку знання хімічних властивостей алюмінію і вміння аналізувати реакції за його участі з погляду окиснення-відновлення.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Нітрогену менша за електронегативність Оксигену й Хлору (рис. 1).
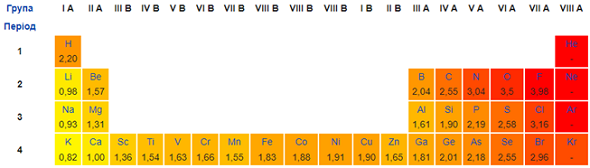
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Cтупені окиснення Нітрогену у зазначених сполуках такі:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Валентність.
Завдання скеровано на перевірку вміння визначати валентність хімічних елементів за формулами оксидів.
Валентність – властивість атомів. Одиниця валентності – це валентність атома Гідрогену. Найвище значення валентності хімічних елементів – VIII. Існують хімічні елементи зі сталою та змінною валентністю. Максимальне значення валентності елемента збігається з номером його групи в періодичній системі (коротка форма). Винятки – Нітроген, Оксиген, Флуор, Купрум тощо.
Значення валентності неметалічного елемента у сполуці з Гідрогеном або металічним елементом дорівнює різниці між числом VIII і номером відповідної групи. У формулах бінарних сполук першим записують символ металічного елемента. Символ Оксигену у формулах бінарних сполук записують другим, за винятком сполуки з Флуором.
У бінарній сполуці сумарна валентність усіх атомів одного елемента дорівнює сумарній валентності всіх атомів іншого елемента. Оксиген в оксидах двовалентний:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Метан. Поширення метану в природі.
Завдання скеровано на перевірку знання поширення метану в природі.Метан є основним складником газів природних займистих (до
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Металічні елементи. Магній. Сполуки Магнію.
Завдання скеровано на перевірку вміння класифікувати оксиди.
Завдання скеровано на перевірку вміння розпізнавати основні оксиди.
Класифікацію оксидів за їхнім складом та хімічними властивостями наведено на рисунку 1.
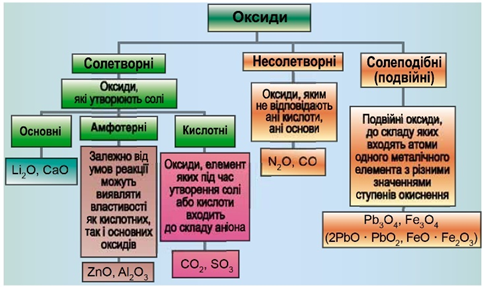
Рис. 1. Класифікація оксидів
Магній – типовий металічний елемент, його оксид
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичний зв’язок між сполуками Кальцію.
Схемі перетворень відповідає кальцій гідроксид:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичний зв’язок між сполуками Сульфуру.
Схемі перетворень відповідають сульфур(VI) оксид і кальцій сульфіт:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Алотропія. Кисень. Озон.
Завдання скеровано на перевірку розуміння алотропії та знання алотропних форм Оксигену.
Алотропія – явище існування одного хімічного елемента у вигляді кількох простих речовин з різними властивостями – алотропних видозмін (модифікацій).
Алотропні модифікації здатні взаємоперетворюватися. Кисень
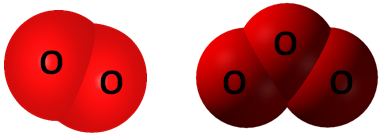
Рис. 1. Моделі молекул алотропних видозмін Оксигену: кисень
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні поняття органічної хімії. Гомологія. Гомологічний ряд.
Завдання скеровано на перевірку розуміння суті гомології.
Речовини з однаковим якісним складом, подібні за будовою і хімічними властивостями, називають гомологами. За кількісним складом вони відрізняються один від одного на одну або декілька груп
Загальна формула вуглеводнів гомологічного ряду етену
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Основні поняття органічної хімії. Гомологія. Гомологічний ряд.
Завдання скеровано на перевірку розуміння суті гомології.
Речовини з однаковим якісним складом, подібні за будовою і хімічними властивостями, називають гомологами. За кількісним складом вони відрізняються один від одного на одну або декілька груп
Загальна формула вуглеводнів гомологічного ряду алканів
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Застосування органічних речовин.
Завдання скеровано на перевірку знання зумовленості застосування речовин їхніми властивостями.
У медицині застосовують як дезінфікувальний водний розчин альдегіду метаналю.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Амфотерність. Нітрогеновмісні органічні сполуки. Амінокислоти.
Завдання скеровано на перевірку розуміння суті амфотерності.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або осно́вні, або кислотні властивості.
Амiно- та карбоксильна групи за хімічною природою протилежні. Карбоксильна група – кислотна, аміногрупа – оснóвна. Тому амінобутанова кислота – амфотерна органічна сполука, бо виявляє властивості як карбонових кислот, так і основ. Її водний розчин не діє на індикатори. Реакції амінокислоти з лугами відбуваються за участі карбоксильної групи, а з кислотами – за участі аміногрупи.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичний зв’язок між органічними сполуками різних класів.
Схемі перетворень відповідає хлорометан:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Органічна хімія. Типи хімічних реакцій в неорганічній та органічній хімії.
Завдання скеровано на перевірку вміння розпізнавати реакції заміщення та приєднання за участі неорганічних й органічних речовин.
Умову завдання задовольняє така пара реакцій:
хлорування етану (заміщення) і приєднання хлору до етену.
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Органічна хімія. Типи хімічних реакцій в неорганічній та органічній хімії.
Завдання скеровано на перевірку вміння розпізнавати реакції обміну.
Умову завдання задовольняють реакції обміну між купрум(ІІ) оксидом і нітратною кислотою та натрій сульфідом і хлоридною кислотою. У цих реакціях і реагенти, і продукти – дві складні речовини:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічна рівновага. Принцип Ле Шательє.
Завдання скеровано на перевірку вміння застосовувати принцип Ле Шательє для визначення напрямку зміщення хімічної рівноваги оборотної реакції.
Для розв’язання завдання потрібно застосувати загальний принцип зміщення хімічної рівноваги, сформульований Ле Шательє. Принцип полягає в тому, що система, яка перебуває в стані стійкої хімічної рівноваги, під зовнішнім впливом (зміною температури, тиску, концентрації реагентів і продуктів реакції тощо) прагне повернутися до стану рівноваги.
Збільшення концентрації продукту реакції приведе до зміщення хімічної рівноваги в бік оберненої реакції.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
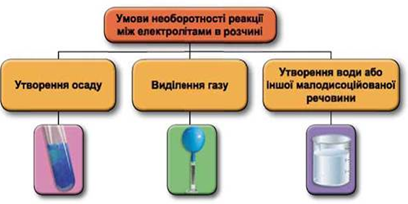
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє реакція між барій гідроксидом і калій сульфатом:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Реакції обміну між електролітами у водному розчині.
Завдання скеровано на перевірку вміння застосовувати знання про умови необоротності перебігу реакцій обміну між електролітами в розчині.
Реакції обміну між електролітами в розчинах відбуваються за участю йонів. Умови необоротності перебігу реакцій обміну між електролітами в розчині наведено на схемі (рис. 1).
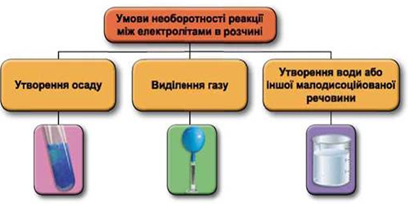
Рис. 1. Умови необоротності реакцій між електролітами у водних розчинах
Умову завдання задовольняє хлоридна кислота, яка не реагує з натрій сульфатом і реагує з натрій карбонатом:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Швидкість хімічної реакції та її залежність від різних чинників.
Завдання скеровано на перевірку вміння застосовувати знання про вплив різних чинників на швидкість хімічної реакції для прогнозування її перебігу за різних умов.
Контактування цинку з менш активним металом міддю сприяє пришвидшенню його хімічної корозії. Подрібнення цинку й збільшення концентрації кислоти також пришвидшують реакцію між ними.
Охолодження реагентів уповільнює хімічну реакцію між цинком і хлоридною кислотою.
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Сірка. Окисно-відновні реакції.
Завдання скеровано на перевірку знання хімічних властивостей сірки та вміння аналізувати реакції за її участі з погляду окиснення-відновлення.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Оксигену більша за електронегативність Сульфуру (рис. 1).
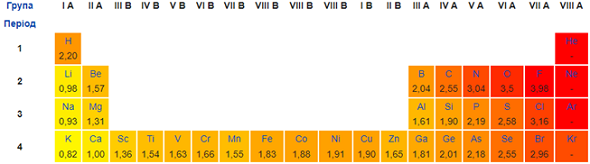
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Тож кисень виявлятиме окисні властивості в реакції із сіркою:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Калій. Водень. Окисно-відновні реакції.
Завдання скеровано на перевірку знання хімічних властивостей водню і калію та вміння аналізувати реакції за їхньої участі з погляду окиснення-відновлення.
Окисно-відновні реакції супроводжувані переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю, тобто змінами ступенів окиснення атомів хімічних елементів.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену складних речовинах зазвичай становлять +1 і –2 відповідно.
Електронегативність Калію менша за електронегативність Гідрогену (рис. 1).
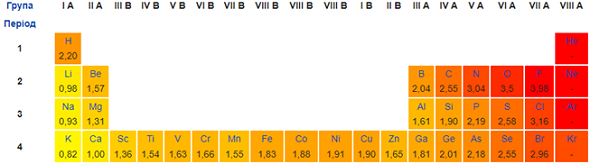
Рис. 1. Зміна електронегативності хімічних елементів у періодичній системі (фрагмент)
Тож калій виявлятиме відновні властивості в реакції з воднем:
Відповідь: B.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Аміни. Анілін.
Завдання скеровано на перевірку знання хімічних властивостей аніліну.
Анілін – ароматичний амін. Він реагує з бромною водою і нітратною кислотою:
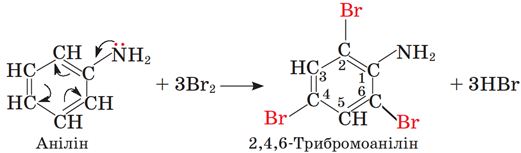
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Вуглеводні. Алкани. Алкіни.
Завдання скеровано на перевірку знання хімічних властивостей алканів й алкінів.
І етан
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Групи хімічних елементів.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у групах.
У групах хімічних елементів зі збільшенням протонного числа збільшується кількість енергетичних рівнів в атомах хімічних елементів.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними речовинами різних класів.
Умову завдання задовольняють хлоридна кислота й натрій гідроксид:
Відповідь: Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними речовинами різних класів.
Умову завдання задовольняють кальцій гідроксид і кальцій карбонат:
Відповідь: A.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електроліз.
Завдання скеровано на перевірку вміння прогнозувати продукти електролізу розтопів солей.
Електроліз – розкладання речовин (наприклад, води, розчинів кислот, лугів, розчинених або розтоплених солей тощо) постійним електричним струмом.
Електроліз полягає в електрохімічних процесах окиснення та відновлення на електродах. Під час електролізу позитивно заряджені йони (катіони) рухаються до катода, на якому електрохімічно відновлюються. Негативно заряджені йони (аніони) рухаються до анода, де електрохімічно окиснюються:
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Карбон(IV) оксид. Парниковий ефект.
Завдання скеровано на перевірку знання причин виникнення парникового ефекту.
Парниковий ефект – нагрівання внутрішніх шарів атмосфери. Парниковий ефект підвищує середню температуру планети, зм’якшує розходження між денними й нічними температурами. Посилення парникового ефекту може призвести до глобальних змін клімату Землі. Парникові гази поглинають теплове випромінювання поверхні Землі та хмар і відбивають його назад до Землі. Найбільше впливають на зміну клімату вуглекислий газ (карбон(IV) оксид
Відповідь: Б.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Будова атома. Електронна формула.
Завдання скеровано на перевірку вміння визначати будову зовнішнього енергетичного рівня атома.
Кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп дорівнює номеру групи в періодичній системі хімічних елементів.
| Назва хімічного елемента | Будова зовнішнього енергетичного рівня атома | ||
| 1 | Нітроген | Г | |
| 2 | Карбон | B | |
| 3 | Сульфур | Д | |
| 4 | Силіцій | A |
Відповідь: 1Г, 2В, 3Д, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Ступінь окиснення.
Завдання скеровано на перевірку вміння визначати ступені окиснення хімічних елементів за формулами сполук.
| Схема реакції | Зміна ступеня окиснення окисника | ||
| 1 |
|
|
B |
| 2 |
|
|
A |
| 3 |
|
|
Г |
| 4 |
|
|
Б |
Відповідь: 1В, 2А, 3Г, 4Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Нітрогеновмісні органічні сполуки. Систематична номенклатура амінокислот.
Завдання скеровано на перевірку вміння називати амінокислоти за систематичною номенклатурою.
| Амінокислота | |||
| Модель молекули | Назва | ||
| 1 | 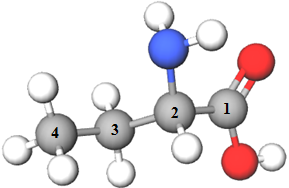 |
2-амінобутанова кислота | Б |
| 2 | 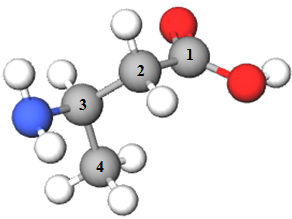 |
3-амінобутанова кислота | Г |
| 3 | 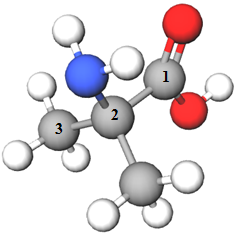 |
2-аміно-2-метилпропанова кислота | B |
| 4 | 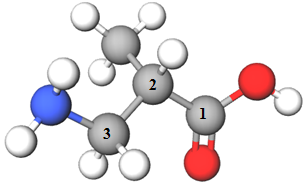 |
3-аміно-2-метилпропанова кислота | A |
Відповідь: 1Б, 2Г, 3В, 4А.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Застосування органічних речовин.
Завдання скеровано на перевірку розуміння зумовленості застосування речовин їхніми властивостями.
| Вуглеводень | |||
| Назва | Застосування | ||
| 1 | дихлорометан | розчинник | Б |
| 2 | трийодометан | загоєння відкритих ран | В |
| 3 | етен | виробництво поліетилену | А |
| 4 | вінілхлорид | виробництво штучної шкіри | Г |
Відповідь: 1Б, 2В, 3А, 4Г.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Металічні елементи. Ферум. Хімічні властивості заліза.
Завдання скеровано на перевірку знання хімічних властивостей заліза.
| Хімічне рівняння | ||
| 1 | Д | |
| 2 | Г | |
| 3 | A | |
| 4 | B |
Відповідь: 1Д, 2Г, 3А, 4В.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Калій. Водень. Окисно-відновні реакції.
Завдання скеровано на перевірку знання хімічних властивостей водню і калію та вміння аналізувати реакції за їхньої участі з погляду окиснення-відновлення.
Ступінь окиснення – це умовний цілочисловий заряд на атомі в молекулярній частинці, якого би він набув, якщо відокремити зв’язані з ним електронегативніші атоми разом із парами електронів, що належать зв’язкам. Це ціле число – додатне, від’ємне або нуль.
Алгебрична сума ступенів окиснення всіх атомів у нейтральній молекулі дорівнює нулю, а в йоні – величині його заряду.
Ступені окиснення атомів Гідрогену й Оксигену у складних речовинах зазвичай становлять +1 і –2 відповідно.
| A | |
| Б | |
| B | |
| Г |
Відповідь: А Б В Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Електронна формула. Закономірності зміни властивостей хімічних елементів у періодичній системі.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у періодичній системі.
У завданні наведено електронні формули атомів елементів третього періоду. У періоді зі збільшенням кількості електронів на зовнішньому енергетичному рівні атомів посилюються неметалічні властивості хімічних елементів.
| Б | |
| A | |
| Г | |
| B |
Відповідь: Б А Г В.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Неорганічна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними речовинами різних класів.
Відповідь: В Б А Г.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Неорганічна хімія. Генетичні зв’язки між класами неорганічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між неорганічними речовинами різних класів.
Відповідь: Г В Б А.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Органічна хімія. Амоніак. Нітрогеновмісні органічні сполуки.
Завдання скеровано на перевірку вміння порівнювати основні властивості амоніаку й амінів.
Неподілена електронна пара атома Нітрогену взаємодіє з ароматичною системою зв’язків і частково зміщується від атома Нітрогену до бензенового кільця. Унаслідок цього на атомі Нітрогену електрон на густина зменшується, і тому зменшуються осно́вні властивості аміногрупи. Тож у воді анілін виявляє слабші основні властивості, ніж амоніак.
Амоніак виявляє слабші основні властивості порівняно з метиламіном, оскільки замісник метил передає частину електронної густини на атом Нітрогену. У диметиламіну основні властивості виражені сильніше, ніж у метиламіну, оскільки в цьому разі електронну густину на атом Нітрогену передають два такі замісники:
Відповідь: Г В А Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
Відповідь: А Б Г В.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Сполуки Сульфуру. Виробництво сульфатної кислоти.
Завдання скеровано на перевірку знання технологічної схеми виробництва сульфатної кислоти.
Технологічну схему виробництва сульфатної кислоти зображено на рисунку 1.
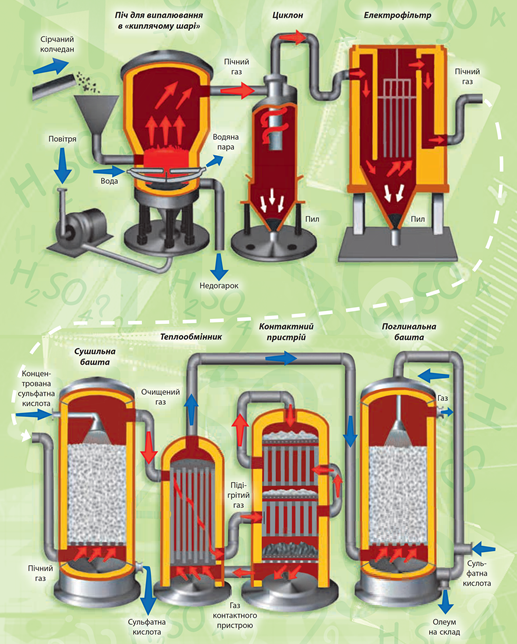
Рис. 1. Технологічна схема виробництва сульфатної кислоти
Відповідь: Б Г А В.
Знайшли помилку? Пишіть на
ТЕМА: Неорганічна хімія. Неметалічні елементи. Галогени. Закономірності зміни властивостей хімічних елементів у групах періодичної системи.
Завдання скеровано на перевірку знання закономірностей зміни властивостей хімічних елементів у групах періодичної системи.
Неметалічні властивості й окисна здатність галогенів зростають у ряду
Відповідь: Б В А Г.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Оксигеновмісні органічні сполуки.
Завдання скеровано на перевірку знання хімічного складу спиртів і вуглеводів.
У молекулі фенолу одна гідроксигрупа.
Гліцерол – триатомний спирт, у його молекулі три гідроксигрупи.
Сорбіт – шестиатомний спирт, у його молекулі шість гідроксигруп.
Крохмаль – полісахарид із великою кількістю гідроксигруп у макромолекулі.
Відповідь: А В Г Б.
Знайшли помилку? Пишіть на
ТЕМА: Органічна хімія. Генетичні зв’язки між класами органічних сполук.
Завдання скеровано на перевірку вміння встановлювати генетичні зв’язки між органічними речовинами різних класів.
Відповідь: В Б Г А.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічні формули. Сполуки Нітрогену.
Завдання скеровано на перевірку вміння аналізувати хімічні формули.
Нітроген – хімічний елемент VА
Відповідь: 7.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Хімічні формули. Органічна хімія. Алкани.
Завдання скеровано на перевірку вміння аналізувати хімічні формули.
Гексан – шостий член гомологічного ряду алканів. Його формула
Відповідь: 20.
Знайшли помилку? Пишіть на
ТЕМА: Загальна хімія. Органічна хімія. Оксигеновмісні органічні сполуки. Фенол.
Завдання скеровано на перевірку вміння складати рівняння реакцій за участі фенолу.
Сума коефіцієнтів у рівнянні реакції
Відповідь: 7.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії.
Завдання скеровано на перевірку вміння перетворювати схеми окисно-відновних реакцій на хімічні рівняння методом електронного балансу.
Кількість відданих електронів –
Відповідь: 6.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічним рівнянням маси реагенту за відомим об’ємом іншого реагенту.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням масу реагенту за відомим об’ємом іншого реагенту.
Дано:
Знайти:
Відповідь: 200.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Визначення найпростішої формули речовини за масовими частками хімічних елементів у ній.
Завдання скеровано на перевірку вміння визначати найпростішу формулу речовини за масовими частками хімічних елементів у ній.
Дано:
Знайти:
Формулі відповідає
Відповідь: 5.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями. Масова частка розчиненої речовини.
Завдання скеровано на перевірку вміння обчислювати масу реагенту за відомою масою іншого реагенту й маси розчину за масовою часткою розчиненої речовини.
Дано:
Знайти:
Відповідь: 16.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями відносного виходу продукту реакції за об’ємом газуватого реагенту.
Завдання скеровано на перевірку вміння обчислювати відносний вихід продукту реакції за об’ємом газуватого реагенту.
Дано:
Знайти:
Відповідь: 80.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічним рівнянням маси продукту за масами реагентів, один із яких узято в надлишку.
Завдання скеровано на перевірку вміння обчислювати за хімічним рівнянням маси продукту за масами реагентів, один із яких узято в надлишку.
Дано:
Знайти:
За рівнянням реакції
За умовою барій нітрат у надлишку, для обчислень використовуємо дані щодо сульфатної кислоти:
Відповідь: 466.
Знайшли помилку? Пишіть на
ТЕМА: Обчислення в хімії. Обчислення за хімічними рівняннями. Визначення формули кристалогідрату.
Завдання скеровано на перевірку вміння визначати формулу кристалогідрату за даними щодо його маси й маси безводної солі.
Дано:
Знайти:
Відповідь: 10.
Знайшли помилку? Пишіть на




